
H2与O2发生反应的过程用模型图示如下(“—”表示化学键):下列说法不正确的是

A.过程Ⅰ是吸热过程
B.过程Ⅲ一定是放热过程
C.该反应过程所有旧化学键都断裂,且形成了新化学键
D.该反应的能量转化形式只能以热能的形式进行
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
25 ℃、101 kPa下:①2Na(s)+O2(g)=Na2O(s) ; ΔH1=-414 kJ/mol
②2Na(s)+O2(g)=Na2O2(s) ; ΔH2=-511 kJ/mol
下列说法正确的是
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25 ℃、101 kPa下,Na2O2(s)+2Na(s)=2Na2O(s) ; ΔH=-317 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是
A.CuCl2 (CuO) B.NaOH (NaOH)
C.CuSO4 (CuCO3) D.NaCl (NaOH)
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-=Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(PCl3)=0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3、2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:实验题
实验测定酸碱中和滴定曲线是高中化学的重要定量实验。下表是用0.10 mol/L的盐酸滴定 0.10 mol/L 20.00 mL NaOH 溶液时获得的一些相关数据。请回答下列问题:
(1)填写表中①②对应的 pH (结果保留两位小数)

(2)下图是本实验的滴定曲线图。请根据该图,说明强酸溶液滴定强碱溶液时,为什么既可以使用甲基橙作为指示剂,又可以使用酚酞试液作指示剂来指示滴定终点?

(3)若在滴定终点时俯视读数,最终测得的氢氧化钠溶液的浓度会 (填“偏大”、“偏小”或“没有影响”,下同);若滴定结束时,滴定管尖嘴悬有半滴标准盐酸,最终测得的氢氧化钠溶液的浓度会;若盛装待测液的锥形瓶洗涤干净后,未干燥即盛装待测液,最终测得的氢氧化钠溶液的浓度会 。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
对于可逆反应 2AB3(g) 2A(g) + 3B2(g) △H >0 ,下列图像不正确的是
2A(g) + 3B2(g) △H >0 ,下列图像不正确的是
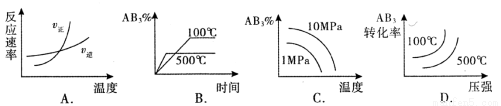
查看答案和解析>>
科目:高中化学 来源:2015届湖北省三校高二上学期期末联考化学试卷(解析版) 题型:选择题
中和滴定是一种操作简单,准确度高的定量分析方法。实际工作中也可以利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是
A.用标准NaOH溶液滴定盐酸溶液以测定其浓度:酚酞试液——浅红色
B.用标准FeCl3溶液滴定KI以测定其浓度:淀粉溶液——蓝色
C.用标准酸性KMnO4溶液滴定Na2SO3溶液以测定其浓度:KMnO4溶液——紫红色
D.利用“Ag++SCN-=AgSCN↓”原理,用标准KSCN溶液滴定AgNO3溶液以测定其浓度:FeCl3溶液——红色
查看答案和解析>>
科目:高中化学 来源:2015届浙江省慈溪市高二上学期期末测试化学试卷(解析版) 题型:填空题
(1)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合 成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:
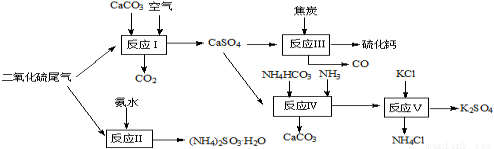
① 生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式 。
② 反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质(已知对苯二酚具有很强的还原性),其作用可能是 。
③ 反应Ⅲ中氧化剂与还原剂的物质的量之比为 。
④ 能用于测定尾气中SO2含量的是 。
A.滴有酚酞的NaOH溶液 B.酸性KMnO4
C.滴有淀粉的碘水 D.BaCl2溶液.
(2)已知铅蓄电池放电时发生如下反应:
负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸溶液浓度为4.50mol.L-1,当制得29.12 L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)________ mol.L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com