
【题目】碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,当外电路中通过0.04 mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
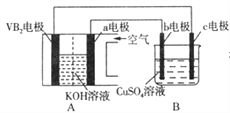
A. VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D. 若B装置内的液体体积为100mL,则CuSO4溶液的物质的量浓度为0.2mol/L
【答案】C
【解析】
A.负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O,故A错误;B.外电路中电子由VB2电极流向阴极c电极,故B错误;C.电解过程中,c为阴极,发生还原反应,先生成铜,后生成氢气,故C正确;D.当外电路中通过0.04mol电子时,B装置内与氧气相连的b为阳极,氢氧根失电子生成氧气为0.01mol,又共收集到0.448L气体即![]() =0.02mol,则阴极也产生0.01moL的氢气,所以溶液中的铜离子为
=0.02mol,则阴极也产生0.01moL的氢气,所以溶液中的铜离子为![]() =0.01mol,则CuSO4溶液的物质的量浓度为
=0.01mol,则CuSO4溶液的物质的量浓度为![]() =0.1mol/L,故D错误;故选C。
=0.1mol/L,故D错误;故选C。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】硫在空气中燃烧可以生成SO2,SO2在催化剂作用下可以被氧化为SO3,其热化学方程式可表示为:S(g) +O2(g)═SO2(g) △H=-297kJ/mol,SO2(g) + 1/2O2(g)![]() SO3(g);△H =-98.3 KJ/mol。下图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量。
SO3(g);△H =-98.3 KJ/mol。下图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6molSO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量。
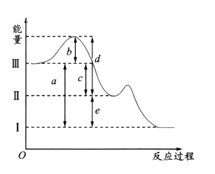
(1)Ⅰ→Ⅱ的反应是________(填“吸热”,“放热”)反应。
(2)c为____________KJ。
(3)图示中b的大小对Ⅲ→Ⅱ反应的△H的影响是______。
A.△H随着b的增大而增大
B.△H随着b的增大而减小
C.△H随着b的减小而增大
D.△H不随b的变化而变化
(4)上图中的d+e-b=________________KJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铝水溶液呈 性,原因是: (用离子方程式表示);把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(2)硫化钠溶于水时发生水解,其水解的离子方程式为 (只写第一步),在配制硫化钠 溶液时可以加入少量的 以抑制其水解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯毗格雷(clopidogrel)是一种用于抑制血小板聚集的药物,以2-氯苯甲醛为原料的合成路线如下:

(1)分子C中能团名称为__________,氯吡格雷的分子式为____________。
(2)X的结构简式为_____________。
(3)两分子C可在一定条件下反应,生成的有机产物中含有3个六元环,写出该反应的化学方程式:_____________________。
(4)物质D的某种同分异构体G满足以下条件:
① 苯环上有两个取代基,且其中一个取代基不含碳原子;② 与D中的官能团相同;③G能发生银镜反应;则符合条件的G有_______种。
(5)已知:![]()
在下列方框内写出由乙烯-甲醇为有机原料制备化合物![]() 的合成路线流程图(无机试剂任选),并标出每步对应的反应类型。_____________________示例如下:
的合成路线流程图(无机试剂任选),并标出每步对应的反应类型。_____________________示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+ 1/2O2(g)CO(g) ΔH1 =—110.5 kJ/mol
CO(g)+ 1/2O2(g)CO2(g) ΔH2 = —283.0 kJ/mol
则反应C(s)+O2(g)CO2(g)的反应热为
A. 172.5 kJ/mol B. —172.5 kJ/mol C. 393.5 kJ/mol D. —393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别代表NaCl、金刚石、干冰、石墨结构的一部分。下列说法正确的是( )
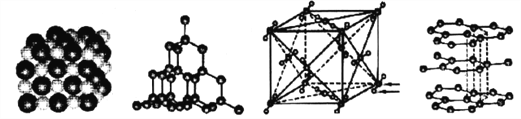
A. NaCl晶体只有在熔融状态下离子键被完全破坏,才能形成自由移动的离子
B. 金刚石中存在的化学键只有共价键,不能导电
C. 干冰中的化学键只需吸收很少的热量就可以破坏,所以干冰容易升华
D. 石墨中碳原子的最外层电子都参与了共价键的形成,故熔点很高、硬度很大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于现行的元素周期表的说法正确的是( )
A.元素周期表有8个副族
B.元素周期表有18个纵行
C.短周期是指第一、二周期
D.ⅠA族的元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如图:

则M、N相比,较稳定的是 。(用字母“M”或“N”表示)
(2)已知CH3OH(l)的燃烧热△H=-238.6kJ/mol,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g)△H=-akJ/mol,则a ________238.6(填“>”、“<”或“=”)。
O2(g)=CO2(g)+2H2(g)△H=-akJ/mol,则a ________238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层生成HCl和CO2,该反应的热化学方程式为____________
2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g)△H=-290kJmol﹣1,当有710gCl2参加反应时放出的热量为____________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,已知4Al(s)+3TiO2(s)+3C(s) =2Al2O3(s)+3TiC(s) △H=-1176kJ/mol,则反应过程中,每转移5mol电子放出的热量为 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com