
【题目】已知:C(s)+ 1/2O2(g)CO(g) ΔH1 =—110.5 kJ/mol
CO(g)+ 1/2O2(g)CO2(g) ΔH2 = —283.0 kJ/mol
则反应C(s)+O2(g)CO2(g)的反应热为
A. 172.5 kJ/mol B. —172.5 kJ/mol C. 393.5 kJ/mol D. —393.5 kJ/mol
科目:高中化学 来源: 题型:
【题目】下列实验对应的现象及结论均正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液有红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+ H2O![]() 2H++ 2CrO42-(黄色)①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+=2Cr3+(绿色) + 6Fe3+ + 7H2O。
2H++ 2CrO42-(黄色)①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1 NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。②向2 mL 0.1 mol·L-1 酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+=2Cr3+(绿色) + 6Fe3+ + 7H2O。
下列分析正确的是
A.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B.实验②能说明氧化性:Cr2O72-> Fe3+
C.CrO42-和Fe2+在酸性溶液中可以大量共存
D.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脂肪、淀粉、蛋白质是三种重要的营养成分,其中 不是高分子化合物,它们都能发生_____________________反应,脂肪的产物是 ,淀粉的最终产物是_________________,蛋白质的最终产物是_____________,提纯蛋白质可以用的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对①100 mL 0.1 mol/L NaHCO3,②100mL 0.1 mol/L Na2CO3两溶液叙述正确的是( )
A.两溶液中c(OH--):①>②
B.两溶液中阳离子数目:②是①的2倍
C.②溶液中:c(HCO3--)<c(H2CO3)
D.①溶液中:c(CO32-)<c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,当外电路中通过0.04 mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
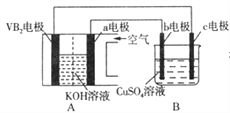
A. VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
B. 外电路中电子由c电极流向VB2电极
C. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D. 若B装置内的液体体积为100mL,则CuSO4溶液的物质的量浓度为0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中手不慎被玻璃划破,可用FeCl3溶液应急止血,其主要原因可能是( )。
A.FeCl3溶液有杀菌消毒作用
B.FeCl3溶液能使血液胶体发生聚沉
C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
D.FeCl3能使血液发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)中和热的测定是高中重要的定量实验。取0.55 mol/L的NaOH溶液50 mL与0.50 mol/L的盐酸50 mL置于图所示的装置中进行中和热的测定实验,回答下列问题
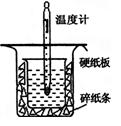
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________ _,除此之外,装置中的一个明显错误是 。
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热数值会_________,(填“偏大”、“偏小”或“不变”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”),简述理由: 。
(4)某实验小组用盐酸和氢氧化钠溶液做了三次实验,每次取溶液各50 mL,并记录下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
2 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
3 | 25.1 | 25.1 | 25.1 | 27.1 | 2.0 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容c=4.18×10-3 kJ/(g·℃),根据计算结果,写出该中和反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图。下列说法正确的是( )
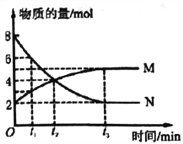
A. M、N之间转化的反应方程式为M =2N
B. t2时刻,反应达到平衡,正、逆反应速率达到相等
C. t3时刻,M的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
D. t1时刻,在容器内气体M和N的物质的量浓度之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com