
A.牛油与NaOH溶液共煮,向反应后所得溶液中加入食盐,会有固体析出
B.一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞
C.向FeCl3溶液中加入Na2CO3溶液,会出现红褐色沉淀
D.在河水与海水的交界处,有三角洲形成
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
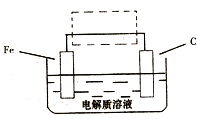 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ①C |
| 高温 |
| ②HCI |
| 300℃ |
| ③过量H2 |
| 1000~1100℃ |
| 物质 | SiHCl3 | SiCl4 | HCl |
| 沸点 | 33.0℃ | 57.6℃ | -84.7℃ |
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二上学期期末考试化学试卷(解析版) 题型:填空题
材料是科学技术进步的关键,是科学技术和社会发展的物质基础。材料的发展不仅影响了人类的昨天和今天,而且还将影响到人类的明天。请回答以下与材料有关的问题。
(1)无机非金属材料。单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿。其主要用途是用做半导体材料和利用太阳能光伏发电、供热等。单晶硅的制备方法如下:

①写出步骤①的化学方程式:______________________。
②已知以下几种物质的沸点:
|
物质 |
SiHCl3 |
SiCl4 |
HCl |
|
沸点 |
33.0 ℃ |
57.6 ℃ |
-84.7 ℃ |
在步骤②中提纯SiHCl3所进行的主要操作的名称是________。
(2)金属材料。金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。包括纯金属、合金和特种金属材料等。
①下列物质中不属于合金的是( )。
A.钢铁 B.青铜 C.硬铝 D.水银
②铜器制品常因接触空气中的O2、CO2和H2O而易生成铜锈。试写出保护铜制品的方法:___________________________________________________。
(3)纳米材料,胶体粒子的直径大约是________,与纳米材料的尺寸相当。实验室制取Fe(OH)3胶体溶液的方法是_________________________________,
用________方法消除胶体中的浑浊,根据________现象证明胶体已经制成。实验中必须要用蒸馏水,而不能用自来水,其原因是____________________。
(4)磁性材料。某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26 g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66 g白色沉淀、过滤、在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。①该磁性粉末中氧元素的质量分数为________;②该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应;二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
(1)、 写出发生氧化还原反应的离子方程式 ;
(2)实验Ⅰ,学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,设计这个实验的目的是___________________。
(3)实验Ⅱ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是___________________。向红褐色液体中逐滴加入稀盐酸至过量。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为__________________。另一份加入BaCl2稀溶液,有少量白色沉淀生成。
(4)实验Ⅲ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ、Ⅲ,产生的现象完全相同。由上述实验得出的结论是______________________________________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是___________________________________________。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________________________________________________________________;
②________________________________________________________________。
Ⅱ.(5分)在某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。向该复盐的浓溶液中逐滴加入浓氢氧化钠溶液。将发生一系列变化。已知,NH4+与AlO2- 在水溶液中不能大量共存,会发生如下反应: NH4++A102-+H2O=Al(0H)3↓+ NH3↑
试回答:
(1)硫酸铝铵在水溶液中的电离方程式为 ;
(2)在逐滴加入浓氢氧化钠溶液的过程中,产生的现象有:①溶液中出现白色沉淀;②有刺激性气体逸出;③白色沉淀量逐渐增多;④白色沉淀完全消失;⑤白色沉淀逐渐减少。请回答各种现象由先到后出现的顺序是(用序号回答): ;
(3)写出滴入氢氧化钠溶液的过程中,有关反应的离子方程式:
① ;
② ;
③ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com