
【题目】已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A.此酸的电离平衡常数约为1×10-7
B.升高温度,溶液的pH增大
C.该溶液的pH=4
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
【答案】B
【解析】
室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则HA是弱酸,溶液中c(H+)=0.1mol/L×0.1%=10-4mol/L;
A.室温时,电离平衡常数K= 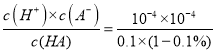 =1×10-7,故A正确;
=1×10-7,故A正确;
B.升高温度促进HA电离,溶液中氢离子浓度增大,则溶液的pH减小,故B错误;
C.溶液中c(H+)=0.1mol/L×0.1%=10-4mol/L,pH=-lgc(H+)=-lg104=4,故C正确;
D.溶液中c(H+)=10-4mol/L,则溶液中c(OH-)=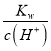 =10-10mol/L,HA溶液中水电离的c(H+)与溶液中的c(OH-)相等,则由HA电离出的c(H+)约为水电离出的c(H+)的
=10-10mol/L,HA溶液中水电离的c(H+)与溶液中的c(OH-)相等,则由HA电离出的c(H+)约为水电离出的c(H+)的![]() =106倍,故D正确;
=106倍,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
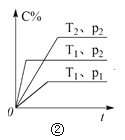
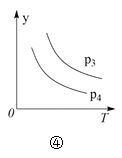
【题目】下列叙述与下图对应的是( )
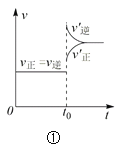
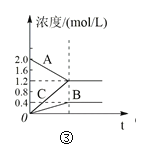
A.对于达到平衡状态的N2(g) + 3H2(g) 2NH3(g),图①表示在t0时刻充入了一定量的NH3,平衡逆向移动
B.由图②可知,p2 > p1,T1 > T2满足反应:2A(g) + B(g) 2C(g) ΔH < 0
C.图③表示的反应方程式为2A = B + 3C
D.对于反应2X(g) + 3Y(g) 2Z(g) ΔH < 0,图④y轴可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对羟基苯甘氨酸乙酯是重要的有机中间体,某课题组以对甲基苯酚为原料设计对羟基苯甘氨酸二聚体的合成路线如图所示(部分反应条件已略去):

已知: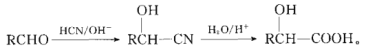
回答下列问题:
(1)B中含氧官能团的名称是_____________。
(2)⑤、⑧的反应类型分别是______________、_______________。
(3)E的结构简式是__________________。
(4)反应③的化学方程式为___________________。
(5)反应⑨的化学方程式为_____________(不必注明反应条件)。
(6)C的同分异构体有多种,其中含有苯环且属于酯类的同分异构体有____种(不考虑立体异构),其中核磁共振氢谱显示只有4种氢的结构简式为______________(任写一种)。
(7)根据上述合成路线和信息,写出以CH2=CHCOOH为原料(无机试剂任选),制备 的合成路线:________。
的合成路线:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() H<0,将一定量的
H<0,将一定量的![]() 充入注射器中密封,测定气体透光率,并压缩注射器,气体透光率随时间的变化如图
充入注射器中密封,测定气体透光率,并压缩注射器,气体透光率随时间的变化如图![]() 气体颜色越深,透光率越小
气体颜色越深,透光率越小![]() 。下列说法正确的是
。下列说法正确的是
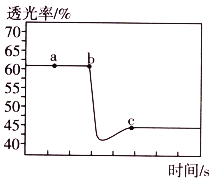
A.a点时化学反应速率为0
B.c点:υ正(NO2)>υ逆(NO2)
C.b点与c点相比,c(NO2)增大,c(N2O4)减小
D.若容器绝热,则平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某溶液中由水电离出的c(OH-)=1×10-13mol/L,该溶液中一定不能大量共存的离子组是( )
A.NH![]() 、Fe3+、SO
、Fe3+、SO![]() 、Cl-B.CO
、Cl-B.CO![]() 、PO
、PO![]() 、K+、Na+
、K+、Na+
C.Na+、SO![]() 、NO
、NO![]() 、Cl-D.HPO
、Cl-D.HPO![]() 、Na+、HSO
、Na+、HSO![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)小明同学想通过比较两种最高价氧化物水化物的酸性强弱来验证S与C的非金属性的强弱,他查阅了资料:可以利用强酸制备弱酸的原理来判断酸性强弱。于是小明采用了下图所示的装置进行实验。请回答:
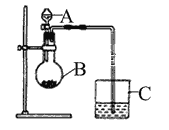
(1)仪器A的名称是________,应盛放下列药品中的__________。
a.稀硫酸 b.亚硫酸 c.氢硫酸 d.盐酸
(2)仪器B的名称是________,应盛放下列药品中的__________。
a.碳酸钙 b.硫酸钠 c.氯化钠 d.碳酸钠
(3)仪器C中盛放的药品是澄清石灰水,如果看到的现象是澄清石灰水变浑浊,证明B中发生反应生成了_____________,即可说明H2SO4 比H2CO3 酸性强,非金属性S比C强,B中发生反应的离子方程式为______________________________。
(II)(1)用电子式表示下列化合物的形成过程:
CaF2:_____________________________________________
H2S:______________________________________________
(2)有下列物质:①NaOH ②I2 ③MgCl2 ④Na2O2 ⑤氩气 回答下列问题:
①不存在化学键的是_________________________,
②既存在离子键又存在极性键的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL某一元弱酸的溶液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。

下列叙述正确的是( )
A.该弱酸在滴定前的浓度是0.15 mol/L
B.该弱酸稀释10倍后pH为4
C.滴定过程为求滴定终点,最合适的指示剂是酚酞
D.滴定过程为求滴定终点,最合适的指示剂是甲基橙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”备受关注,研究和深度开发![]() 的应用对构建生态文明社会具有重要的意义。
的应用对构建生态文明社会具有重要的意义。

(1)![]() 是一种性能优良的光催化剂,能有效地将有机污染物转化为
是一种性能优良的光催化剂,能有效地将有机污染物转化为![]() 等小分子物质。图1为在
等小分子物质。图1为在![]() 的催化下,
的催化下,![]() 降解
降解![]() 的示意图,则该反应的化学方程式为____________________________。
的示意图,则该反应的化学方程式为____________________________。
(2)将一定量的![]() 和
和![]() 通入一恒容密闭容器中发生反应:
通入一恒容密闭容器中发生反应:![]() 。
。
![]() 化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧的相关热化学方程式如下:
化学链燃烧技术是目前能源领域研究的热点之一,用NiO作载氧体的化学链燃烧的相关热化学方程式如下:
![]()
![]()
则反应![]() 的
的![]() _______。
_______。
![]() 为了探究反应
为了探究反应![]() 的反应速率与浓度的关系,起始时向恒容密闭容器中通入
的反应速率与浓度的关系,起始时向恒容密闭容器中通入![]() 与
与![]() ,并使二者物质的量浓度均为
,并使二者物质的量浓度均为![]() ,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线
,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线![]() 如图
如图![]() :
:![]() 和
和![]() 。则与曲线
。则与曲线![]() 相对应的是图中曲线________
相对应的是图中曲线________![]() 填“甲”或“乙”
填“甲”或“乙”![]() ;该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________
;该反应达到平衡后,某一时刻降低温度,反应重新达到平衡,则此时曲线甲对应的平衡点可能为________![]() 填字母
填字母![]() 。
。
(3)用稀氨水喷雾捕集![]() 最终可得产品
最终可得产品![]() 。
。
![]() 在捕集时,气相中有中间体
在捕集时,气相中有中间体![]() 氨基甲酸铵
氨基甲酸铵![]() 生成。现将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中,分别在不同温度下进行反应:
生成。现将一定量纯净的氨基甲酸铵置于恒容密闭真空容器中,分别在不同温度下进行反应:![]() 。实验测得的有关数据如下表
。实验测得的有关数据如下表![]() :
:

氨基甲酸铵的分解反应是________![]() 填“放热”或“吸热”
填“放热”或“吸热”![]() 反应。在
反应。在![]() ,此反应的化学平衡常数
,此反应的化学平衡常数![]() ________。
________。
![]() 在
在![]() 溶液中,反应
溶液中,反应![]() 的平衡常数
的平衡常数![]() 。已知常温下
。已知常温下![]() 的电离平衡常数
的电离平衡常数![]() ,则
,则![]() 的电离平衡常数
的电离平衡常数![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
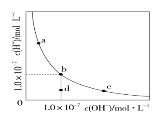
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com