
2 1 |
18 8 |
| ||
| m |
| M |
| m |
| M |
| m |
| n |
| m |
| M |
| 11g |
| 22g/mol |
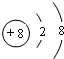 ,
,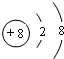 ;
;| 1g |
| 64g/mol |
| 1 |
| 64 |
| 1g |
| 80g/mol |
| 1 |
| 80 |
| 1 |
| 64 |
| 1 |
| 80 |
| 1 |
| 64 |
| 1 |
| 80 |
| 1 |
| 64 |
| 1 |
| 80 |
| 20.6g |
| 0.2mol |
| 8g |
| 80g/mol |
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某石蕊的分子结构如图所示.
某石蕊的分子结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔融的NaCl(阳极) |
| B、NaCl溶液(阴极) |
| C、NaOH溶液(阴极) |
| D、Na2SO4(阳极) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、家用炒锅残留盐溶液时易发生吸氧腐蚀 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、电解水制氢气时,用铜作阳极 |
| D、在镀件上电镀锌,用锌作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生石灰与水混合的过程只发生物理变化 |
| B、可用丁达尔效应区分溶液与胶体 |
| C、O3是由3个氧原子构成的化合物 |
| D、CuSO4?5H2O是一种混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com