
| V |
| Vm |
| m |
| ρ |
| n |
| V |
| 700L |
| 22.4L/mol |
| 700 |
| 22.4 |
| 700 |
| 22.4 |
| 17×700 |
| 22.4 |
1000g+
| ||
| 900g/L |
| 22400+17×700 |
| 22.4×900 |
| ||
|


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、电池反应的化学方程式为:2Li+FeS═Li2S+Fe |
| B、负极的电极反应式为:Al-3e-=Al3+ |
| C、Li-Al在电池中作为负极材料,该材料中Li的化合价是+1 |
| D、电池充电时,阴极反应为:Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
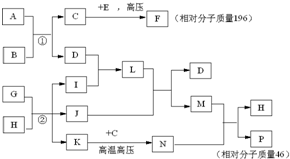 已知C、I、J是常见的气体,A、D是常见的固态非金属单质,E为常见金属,B可用于生产光导纤维,G、H是海水中的主要物质,N是一种盐.在核磁共振氢谱中P有两种峰,F燃烧产生红棕色烟,1molF在真空中完全分解剩余固体的质量是原来的28.6%.试回答下列问题
已知C、I、J是常见的气体,A、D是常见的固态非金属单质,E为常见金属,B可用于生产光导纤维,G、H是海水中的主要物质,N是一种盐.在核磁共振氢谱中P有两种峰,F燃烧产生红棕色烟,1molF在真空中完全分解剩余固体的质量是原来的28.6%.试回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
2 1 |
18 8 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可能有c(Na+)>c(A-)>c(HA)>c(OH-)>c(H+) | ||
| B、必定有 c(HA)>c(Na+) | ||
C、可能有c(OH-)=c(H+)+
| ||
| D、c(HA)可能大于0.2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com