
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:
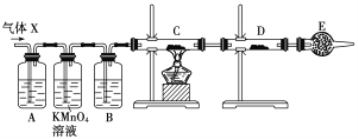
(1)上述反应中生成二氧化硫的化学方程式为______________________________。
(2)乙同学认为还可能产生氢气的理由是__________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是________________________。
(4)A中加入的试剂可能是_____,作用是__________________________________;B中加入的试剂可能是_____,作用是__________________________________;E中加入的试剂可能是_____,作用是__________________________________。
(5)可以证明气体X中含有氢气的实验现象是:C中:_________________________,D中:_________________________ 。如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?_____ (填“能”或“不能”),原因是______________________________________________________。
【答案】Zn+2H2SO4(浓)==Z nSO4+SO2↑+2H2O 当Zn与浓H2SO4反应时,浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2 检查装置的气密性 品红溶液 检验SO2 浓H2SO4 吸收水蒸气 碱石灰 防止空气中水蒸气进入D中 黑色(CuO)变成红色(Cu) 白色粉末变成蓝色 不能 因为混合气体中含H2O,会干扰H2的检验
【解析】
浓硫酸具有强氧化性,与Zn反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,随着反应的进行,浓硫酸变为稀硫酸,可能发生Zn与稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑,验证H2的存在,通过H2还原氧化铜进行;
(1)生成SO2,发生的化学方程式为Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O;
(2)随着反应进行,浓硫酸的浓度降低,Zn与稀硫酸发生Zn+H2SO4=ZnSO4+H2↑,产生氢气;
(3)需要通入气体,因此实验必不可缺少的一步操作是检验装置的气密性;
(4)根据实验目的,需要检验SO2、H2,检验SO2:利用SO2能使品红溶液褪色,H2不行,因此装置A中盛放的试剂是品红,作用是检验SO2存在;酸性高锰酸钾溶液作用是除去SO2,防止SO2干扰后续实验;检验H2的存在,氢气还原CuO,需要检测H2O,因此装置B中盛放的试剂为浓硫酸,作用是吸收水蒸气,干燥氢气;C装置盛放CuO,D装置盛放无水CuSO4,E装置盛放的试剂可能为碱石灰,防止空气中水蒸气进入D装置,干扰对H2O的检验;
(5)根据(4),证明气体中有氢气,C中现象是黑色变为红色,D中:白色粉末变成蓝色;如果去掉B装置,从高锰酸钾溶液中出来的气体带有水蒸气,对H2的检验产生干扰,因此去掉B装置,不能根据D装置现象判断是否含有H2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列物质所含分子数最少的是
A. 标准状况下4.48L二氧化碳 B. 3.2g氧气
C. 含0.4NA个分子的氢气 D. 0.5mol氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g) ![]() CH3OH(g)的反应热△H4=________________。
CH3OH(g)的反应热△H4=________________。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) ![]() CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。

(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=_______________________。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积______5 L(填“>”“<”或“=”);T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=____________________________。
CH3OH(g)的平衡常数K=____________________________。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:_________________________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经测定谷氨酸的同系物——天门冬氨酸中含氧百分率为48.1%,若用0.01mol天门冬氨酸与足量盐酸反应,将所得的盐配成100mL溶液,取10mL用0.2mol/L烧碱溶液滴定,当完全反应时耗碱液15mL。则天门冬氨酸的相对分子质量为______________,分子式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2a L Al2(SO4)3和(NH4)2SO4的混合溶液分为两等份,其中一份加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;另一份加入足量强碱并加热可得到c mol NH3气体,则原混合溶液中的Al3+浓度(mol/L)为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲烷、乙烯、苯、甲醇、乙酸等有机物。
(1)写出上述物质中能发生下列指定反应的化学方程式。
与浓硝酸发生取代反应:_________________________;
与Cl2发生光照下的反应(只写一个反应):___________________________;
与甲醇(CH3OH)发生酯化反应:____________________。
(2)完全燃烧等物质的量的上述物质,生成物中H2O和CO2的物质的量相等的是________,消耗O2的量相等的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山梨酸是目前国际上公认的安全防腐剂。山梨酸可由山梨醛经如下过程合成:
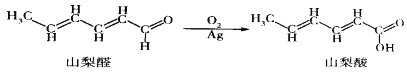
下列有关说法正确的是( )
A. 山梨酸与CH2=CH-COOH互为同系物
B. 山梨醛能发生取代、氧化、还原和加成反应
C. 与山梨酸含有相同官能团且含一个五元环的山梨酸的同分异构体有5种
D. 山梨酸分子中处于同一平面的原子最多13个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com