
【题目】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g) ![]() CH3OH(g)的反应热△H4=________________。
CH3OH(g)的反应热△H4=________________。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) ![]() CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。

(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=_______________________。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积______5 L(填“>”“<”或“=”);T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=____________________________。
CH3OH(g)的平衡常数K=____________________________。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:_________________________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:_________。
【答案】-574.4kJ/mol d 0.064mol/(L·min) > 625 CH3OH-6e-+8OH-=CO32-+6H2O 外加电流的阴极保护法 5CH3OH+6ClO2=6Cl-+5CO2+6H++7H2O
【解析】
(1)结合热化学方程式和盖斯定律计算,①+②×2-③得到CO(g)+2H2(g)![]() CH3OH(g)的热化学方程式,求出焓变;
CH3OH(g)的热化学方程式,求出焓变;
(2)该反应为放热反应,根据平衡状态的特征判断各图象;
(3)结合化学三段式法列式计算,反应速率为v(H2)=△c/△t,气体物质的量之比等于气体体积之比,平衡常数随温度变化,K=生成物平衡浓度幂之乘积/反应物平衡浓度幂之积;
(4)燃料原电池中,燃料失电子发生氧化反应为负极,通入氧气得到电子发生还原反应为正极,电解池中阴极被保护;
(5)根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水。
(1)已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
根据盖斯定律计算①+②×2-③得到CO(g)+2H2(g)![]() CH3OH(g)的热化学方程式的△H4=-574.4KJ·mol-1;
CH3OH(g)的热化学方程式的△H4=-574.4KJ·mol-1;
(2)a、在图1中,t1时刻如果达到平衡,正反应速率应不变,而不是随时间间改变而减小,故a错误;
b、充入1molCO、2molH2,生成甲醇放出热量,反应体系的温度升高,K减小,而不是增大,故b错误;
c、t1时刻一氧化碳与甲醇的物质的量相等,但二者物质的量依然在变化,不是平衡状态,故c错误;
d、随着反应的进行,一氧化碳的质量减小,一氧化碳的质量分数不变,说明各物质的质量不变,反应达平衡状态,故d正确;故选d。
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,根据三段式法有:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol·L-1) 0.2 0.4 0
变化量(mol·L-1) 0.16 0.32 0.16
平衡量(mol·L-1) 0.04 0.08 0.16
则5min内用H2表示的反应速率为v(H2)=0.32mol·L-1/5min=0.064mol/(L·min);
温度不变,T1℃时,在另一体积不变的密闭容器中也充入1mol CO、2mol H2,达到平衡时CO的转化率为0.7,转化率减小说明平衡左移,体积增大,则该容器的体积大于5 L;
T1℃时,CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=0.16/(0.04×0.082)=625;
CH3OH(g)的平衡常数K=0.16/(0.04×0.082)=625;
(4)燃料原电池中,甲醇失电子发生氧化反应,通入燃料甲醇的电极为负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,当电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,是利用铁闸做电解池阴极被保护,名称为:外加电流的阴极保护法;
(5)根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水,根据得失电子守恒和原子守恒,该反应的离子方程式为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O。


科目:高中化学 来源: 题型:
【题目】甲烷(CH4)和丙烷(C3H8)的混合气体的密度与同温同压下乙烷(C2H6)的密度相同,则混合气体中CH4和C3H8的体积比为
A.2:1B.3:1C.1:3D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻,请回答下列问题:
(1)写出单质R的一种工业用途_______________________。
(2)M和R的最高价氧化物的水化物中酸性最强的是___________(用化学式表示)。
(3)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式为____________________。
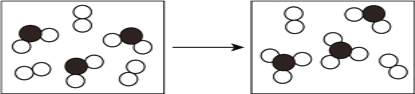
(4)由X、Y、Z、M四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(5)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,已知QX5中含有离子键和极性键,写出化合物的电子式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据美国《农业研究》杂志报导,美国的科学家发现半胱氨酸能增强艾滋病毒感染者的免疫力,对控制艾滋病的蔓延有奇效。已知半胱氨酸的结构式为:![]() ,则下列说法错误的是( )
,则下列说法错误的是( )
A. 半胱氨酸属α-氨基酸
B. 半胱氨酸是一种两性物质
C. 两个半胱氨酸发生缩合反应可能生成两种不同的二肽
D.  可与NaOH溶液反应放出一种碱性气体
可与NaOH溶液反应放出一种碱性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事故处理方法正确的是( )
A. 汽油失火时,立即用水灭火
B. 电线短路失火时,首先要用泡沫灭火器灭火
C. 浓氢氧化钠溶液溅到皮肤上,立即用大量水冲洗,然后涂上稀硼酸溶液
D. 温度计的水银球打破洒在地面上的水银,可以用水冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台,化合物E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:

回答下列问题:
(1)葡萄糖的分子式为___________________。
(2)A中含有的官能团的名称为_________________。
(3)由B到C的反应类型为___________________。
(4)C的结构简式为___________________________。
(5)由D到E的反应方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题:
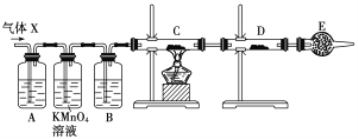
(1)上述反应中生成二氧化硫的化学方程式为______________________________。
(2)乙同学认为还可能产生氢气的理由是__________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是________________________。
(4)A中加入的试剂可能是_____,作用是__________________________________;B中加入的试剂可能是_____,作用是__________________________________;E中加入的试剂可能是_____,作用是__________________________________。
(5)可以证明气体X中含有氢气的实验现象是:C中:_________________________,D中:_________________________ 。如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?_____ (填“能”或“不能”),原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 10mL0.1mol·L-1Na2CO3溶液逐滴滴加到10mL0.1mol·L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
B. NH4HCO3溶液中存在:C(NH4+)=C(HCO3-)+C(CO32-)+C(H2CO3)
C. 常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=3.6×10-10
D. 若两种盐溶液的浓度相同且pH(NaX)>pH(NaY),则c(X-)+c(OH-)<c(Y-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com