
【题目】四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],其工作原理如图所示(a、b 为石墨电极,c、d、e 为离子交换膜),下列说法不正确的是
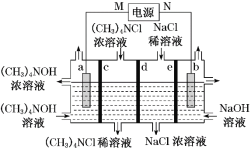
A.N 为电源正极
B.b 极 电 极 反 应 式 : 4OHˉ-4eˉ=O2↑+2H2O
C.c 为阳离子交换膜,d、e 均为阴离子交换膜
D.a、b 两极均有气体生成,同温同压下体积比为 2∶1
【答案】C
【解析】
以四丁基溴化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH]的过程中,根据第三个池中浓度变化得出:钠离子从第四池通过e膜,氯离子从第二池通过d膜,得到c、e均为阳离子交换膜,a为阴极b为阳极,阳极电极反应式为4OH--4e-=O2↑+2H2O。
A.a为阴极b为阳极,N 为电源正极,故A正确;
B.b为阳极,发生氧化反应,b 极 电 极 反 应 式 : 4OHˉ-4eˉ=O2↑+2H2O,故B正确;
C.钠离子从第四池通过e膜,氯离子从第二池通过d膜,得到c、e均为阳离子交换膜,d 为阴离子交换膜,故C错误;
D.a电极为氢离子放电生成氢气,故电极反应方程式为2H++2e-=H2↑,b电极为氢氧根离子放电生成氧气4OH--4e-=O2↑+2H2O,标况下制备1mol(CH3)4NOH,转移电子是1mol,a、b两极产生气体物质的量分别为0.5mol和0.25mol, a、b 两极均有气体生成,同温同压下体积比为 2∶1,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
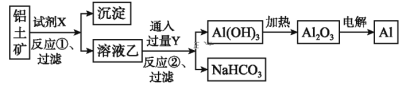
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于摩尔质量的描述或应用中正确的是
A. 一个钠原子的质量等于![]() g B. 二氧化碳的摩尔质量是44 g
g B. 二氧化碳的摩尔质量是44 g
C. 铁原子的摩尔质量等于它的相对原子质量 D. 1 mol氢氧根离子的质量是17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,X是铁,Y是石墨电极,a是硫酸钠溶液,实验开始前,在U形管的两边同时各滴入几滴酚酞溶液,下列叙述正确的是( )

A. 闭合K1,断开K2,X极放出H2
B. 闭合K1,断开K2,Y极为阳极
C. 闭合K2,断开K1,Y极的电极反应式为O2+2H2O+4e-=4OH-
D. 闭合K2,断开K1,工作一段时间后,X电极附近溶液显红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 和 W 代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z 与 Y、W 均相邻;②X、Y、W 分别位于不同周期;③Y、Z、W 三种元素的原子最外层电子数之和为 17。下列说法正确的是
A.四种元素非金属性从弱到强的顺序为:X<W<Z<Y
B.四种元素的原子半径由小到大的顺序为:r(X)<r(Y)<r(Z)<r(W)
C.X 与其余三种元素之间形成的核外电子总数为 10 的微粒只有 4 种
D.X、Y、Z 既能形成离子化合物,又能形成共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】600℃时,在 2 L 的恒容密闭容器中充入一定量的 CO 和 H2O,发生反应: CO (g)+H2O (g) ![]() CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:
CO2(g)+H2 (g)。反应过程中的部分数据如下表所示:

下列说法正确的是
A.0~5 min 用 CO 表示的平均反应速率为 0.08mol·L1·min1
B.该反应在 10 min 后才达到平衡
C.温度升高至 800℃时,反应平衡常数为 0.64,则正反应为吸热反应
D.保持其他条件不变,起始时向容器中充入 0.60 molCO 和 1.20 molH2O,达到平衡时 n(CO2)=0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质分类是基本的化学思路。下表是几种常见物质的分类情况:
单质 | 氧化物 | 酸 | 碱 | 盐 |
Mg、S、C、N2 | CaO、CO2 | HCl、H3BO3 | KOH、NH3 H2O | KNO3、K2S |
回答下列问题
(1)下列物质可导电的是_____________;是电解质的是_______________。
①HCl(液态) ②HCl(稀溶液) ③KOH(固体) ④KOH(熔融状态) ⑤KOH(稀溶液)
(2)从上表选择两种物质,发生反应属于化合反应但不属于氧化还原反应,该反应的化学方程式为_____________。(任写一个即可)
(3)点燃时,镁可以在氮气中燃烧,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目__________________。
(4)酸按不同标准分类得到的结果是不同的。已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4-,则H3BO3属于_____元酸,其电离方程式为______。
(5)黑火药是我国古代伟大的科学发明,反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,若生成22.4L N2(标准状况下),则被氧化的C是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中错误的是( )

A.只有①和②处B.只有②处C.只有②和③处D.只有②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是

A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com