
����Ŀ�����ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������A�ĺ����������������Ӳ�����ͬ��b�ļ۵��Ӳ��е�δ�ɶԵ�����3����c������������Ϊ���ڲ��������3����d��cͬ���壬e�������ֻ��1�����ӣ����������18�����ӣ��ش��������⣺
��1��b��c��d�е�һ����������������Ԫ�ط��ţ���e�ļ۲���ӹ��ʾ��ͼΪ ��
��2��a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪ�������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ����������ѧʽ��д���֣���
��3����ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������������������ṹ������ �� ���ѧʽ��
��4��c��e�γɵ�һ�����ӻ�����ľ���ṹ��ͼ1����e���ӵĵ��Ϊ ��
��5����5��Ԫ���γɵ�һ��1��1�����ӻ������У������ӳ�������ṹ�������ӳ����������İ�����ṹ����ͼ2��ʾ�����û�������������Ϊ �� �������д��ڵĻ�ѧ�����������û��������ʱ����ʧȥ������� �� �ж������� �� 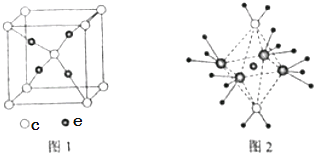
���𰸡�
��1��N��![]()
��2��sp3��H2O2��N2H4
��3��HNO2��HNO3��H2SO3
��4��+1
��5��SO42�������ۼ�����λ����H2O��H2O��Cu2+����λ����NH3��Cu2+����
���������⣺���ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a�ĺ����������������������ͬ����a��HԪ�أ�
c������������Ϊ���ڲ��������3����ԭ��������������8������C��OԪ�أ�d��cͬ�壬��d��SԪ�أ�
b�ļ۵��Ӳ��е�δ�ɶԵ�����3������ԭ������С��c����b��NԪ�أ�
e�������ֻ��һ�����ӣ����������18�����ӣ���e��CuԪ�أ���1��b��c��d�ֱ���N��O��SԪ���У�Ԫ�صķǽ�����Խǿ�����һ������Խ��ͬһ����Ԫ���У���һ����������ԭ��������������������ƣ�����VA��Ԫ�ش�������Ԫ�أ�����N��O��S�е�һ������������NԪ�أ�e�ļ۲�Ϊ3d��4s���ӣ�����ӹ��ʾ��ͼΪ ![]() ��
��
���Դ��ǣ�N�� ![]() ����2��a��HԪ�أ�a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷���Ϊ���������������е�ԭ�Ӻ���3�����ۼ���һ���µ��Ӷԣ����Ը÷��ӵ�����ԭ�ӵ��ӻ���ʽΪsp3�������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ�������H2O2��N2H4 ��
����2��a��HԪ�أ�a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷���Ϊ���������������е�ԭ�Ӻ���3�����ۼ���һ���µ��Ӷԣ����Ը÷��ӵ�����ԭ�ӵ��ӻ���ʽΪsp3�������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ�������H2O2��N2H4 ��
���Դ��ǣ�sp3��H2O2��N2H4����3����ЩԪ���γɵĺ������У����ӵ�����ԭ�ӵļ۲���Ӷ���Ϊ3������HNO2��HNO3������������ṹ������H2SO3 ��
���Դ��ǣ�HNO2��HNO3��H2SO3����4��e��c�γɵ�һ�����ӻ�����ľ���ṹ��ͼ1��c���Ӹ���=1+8�� ![]() =2��e���Ӹ���=4�����Ըû�����ΪCu2O����e���ӵĵ��Ϊ+1��
=2��e���Ӹ���=4�����Ըû�����ΪCu2O����e���ӵĵ��Ϊ+1��
���Դ��ǣ�+1����5����5��Ԫ���γɵ�һ��1��1�����ӻ������У������ӳ�������ṹ��˵�������ӵ�����ԭ�Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ�Ϊ��������ӣ������ӳ����������İ�����ṹ����ͼ2��ʾ��������ͼ��֪�������ӵ���λ����6���������к��й��ۼ�����λ���������Ӹ�����4��ˮ���Ӹ�����2���仯ѧʽΪ[Cu��NH3��4��H2O��2]SO4 �� H2O��Cu2+����λ����NH3��Cu2+���������Ըû��������ʱ����ʧȥ�������H2O��
���Դ��ǣ�SO42�������ۼ�����λ����H2O��H2O��Cu2+����λ����NH3��Cu2+������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������������Ӧ�ĵ�λ��ƥ�����
A. Ħ��������gB. ����Ħ�������L/mol
C. ���ʵ�����molD. ���ʵ���Ũ�ȣ�mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������:��Na2O����Na2O2����NaCl����Na2CO3��Һ����NaOH��Һ����NaHCO3��Һ�����в�����CO2��Ӧ����(����)
A. �٢� B. �ڢ� C. �ۢ� D. �ݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����ȡþ�漰���Ļ�ѧ��Ӧ�У���CaO+H2O=Ca��OH��2����Mg2++2OH��=Mg��OH��2������Mg��OH��2+2HCl=MgCl2+2H2O����MgCl2 ![]() Mg+Cl2��û���漰���ķ�Ӧ�����ǣ� ��
Mg+Cl2��û���漰���ķ�Ӧ�����ǣ� ��
A.���Ϸ�Ӧ
B.�ֽⷴӦ
C.�û���Ӧ
D.���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������յ���������Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3��������������������ȡ��ˮ������������FeSO4��7H2O����������������̣�
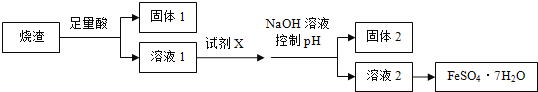
��֪����������������������ʽ����ʱ��Һ��pH ���±���
������ | F e��OH��3 | Fe��OH��2 | Al��OH��3 |
��ʼ���� | 2.3 | 7.5 | 3.4 |
��ȫ���� | 3.2 | 9.7 | 4.4 |
�ش��������⣺
��1���Լ�XӦѡ��________________��
��2������pH �ķ���_________________��
��3������Һ2�õ�FeSO4��7H2O ��Ʒ�Ĺ����У������������ֹ�������ͷֽ⣬����FeSO4��Һ�Ƿ���ʵķ�����______________��
��4�� ������Һ1�����Ʊ�һ������Ч��ˮ�������ۺ���������[Al2Feb��OH��m��SO4��n��xH2O]��Ϊ�˲ⶨij�־ۺ�������������ɣ���������ʵ�飺
����һ��ȷ��ȡ8.810g ��Ʒ����150mL0.100mol��L-1ϡ���ᣬǡ����ȫ��Ӧ����BaCl2��Һ��������ȫ�����ˡ�ϴ�ӡ����������أ��õ���ɫ����10.485g��
���������ȡ��ͬ��������Ʒ�����ڹ���������ᣬ��ֽ��跴Ӧ����0.500mol��L-1 Na2S2O3��Һ�ζ���dz��ɫ�����뼸�ε�����Һ�������ζ����յ㣬����Na2S2O3��Һ20.00mL��
����֪��I2+2Na2S2O3=2NaI+Na2S4O6 ��
ͨ������ȷ���þۺ����������Ļ�ѧʽ______________����д�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������A������ת����ϵ�� 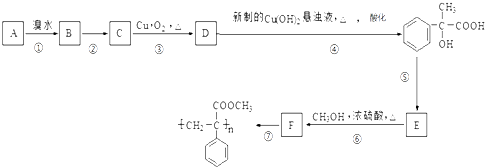
��Ҫ����գ�
��1��д��D�����������ŵ����� �� ָ���ݵķ�Ӧ���� ��
��2����Ӧ�ڵķ�Ӧ������
��3��д��A��F�ṹ��ʽ��A��F
��4��д����Ӧ�۶�Ӧ�Ļ�ѧ����ʽ��
��5��д��D������Cu��OH��2����Һ��Ӧ�Ļ�ѧ����ʽ��
��6��E��������������ͬ���칹���ж��֣���д����һ����ͬʱ���������������칹��Ľṹ��ʽ ��
a�������ϵ�һ�ȴ���������
b����FeCl3��Һ������ɫ��Ӧ
c������Br2/CCl4�����ӳɷ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1905��¹���ѧ�ҹ��������˺ϳɰ��ķ���������˻����1918���ŵ������ѧ�������ĺϳɲ�������˵���������ʳ��������µļ������������⣬�ڹ�������Դ���Ṥҵ����Ҳ�й㷺��;��
����Ϊԭ�ϣ��ϳ����صķ�Ӧԭ��Ϊ��
2NH3��g��+CO2��g���TCO��NH2��2��l��+H2O��g����H=a kJ/mol��
Ϊ�о�ƽ��ʱCO2��ת�����뷴Ӧ��Ͷ�ϱȣ� ![]() �����¶ȵĹ�ϵ���о�С����10L�����ܱ������н���ģ�ⷴӦ���������ͼ�������߷ֱ��ʾ�ڲ�ͬͶ�ϱ�ʱ��CO2��ת�������¶�֮��Ĺ�ϵ����
�����¶ȵĹ�ϵ���о�С����10L�����ܱ������н���ģ�ⷴӦ���������ͼ�������߷ֱ��ʾ�ڲ�ͬͶ�ϱ�ʱ��CO2��ת�������¶�֮��Ĺ�ϵ����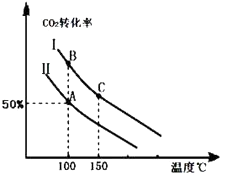
��1��a0 ���������������������� ��
��2����Ͷ�ϱȣ����������������
����n��CO2����ʼ=10mol�����ߢ��Ͷ�ϱ�Ϊ0.4����100�������·�����Ӧ����ƽ����A�㣬��A������ʼѹǿ��Ϊ ��
��A��ƽ�ⳣ����B��ƽ�ⳣ����Ĺ�ϵ��KAKB�������������=������B������Ӧ������C������Ӧ���ʼ�Ĺ�ϵΪ��v��B��v��C���������������=������
��3���������ߢ��Ͷ�ϱ�Ͷ�ϣ�������ʵ����ѹ�����������5L����ͼ�л�����Ӧ��ƽ��ʱ�Ķ�����̼��ת�������¶�֮��Ĺ�ϵ���ߣ�
��4��Ϊ���CO2ת���ʿ��Բ�ȡ�Ĵ�ʩ�� ��
a��ʹ�ô��� b����ʱ����ϵ�з��������CO��NH2��2c������ϵ�е�ˮ����Һ������
���������ڹ�ҵ���������ᣬ��β���е�NO2���ð�ˮ������������泥�25��ʱ����10molNH4NO3����ˮ����Һ�����ԣ������Һ�еμ�1LijŨ�ȵİ�ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ�����ˮ�ĵ���ƽ�⽫����������������� �ƶ�����������Һ��NH3H2O�����ʵ���Ϊmol����25��ʱ��NH3H2O�ĵ���ƽ�ⳣ��Kb=2��10��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ƽ�������и�����һ��������ȵ��ձ������ձ��и�ʢ��100mL1mol/L ������Һ�������ձ��зֱ��������е��������ʣ���Ӧ����ƽ����ƽ����ǣ� ��
A.0.1mol Zn��0.1mol Fe
B.1mol Fe��1mol Zn
C.1g Zn��1g Fe
D.10g Zn��10g Fe
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com