
| 28g |
| 28g/mol |


科目:高中化学 来源: 题型:
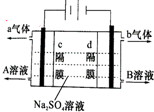 双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是( )
双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是( )| A、a气体为氢气,b气体为氧气 | ||||
| B、A溶液为氢氧化钠,B溶液为硫酸 | ||||
| C、c隔膜为阳离子交换膜、d隔膜为阴离子交换膜 | ||||
D、该电解反应的总方程式可以表示为:2Na2SO4+6H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,“氢化油”呈液态 |
| B、纤维素和淀粉均属于糖类,它们在人体内水解的最终产物均为葡萄糖 |
| C、可用酒精萃取水中的碘 |
| D、可用灼烧闻气味的方法来区别棉织物和毛织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3mol/LHCl溶液 |
| B、4mol/LHNO3溶液 |
| C、8mol/LNaOH溶液 |
| D、18mol/LH2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| A、该反应中的氧化剂只有Cu2O |
| B、Cu2S在反应中既是氧化剂又是还原剂 |
| C、Cu既是氧化产物又是还原产物 |
| D、氧化产物与还原产物的物质的量之比为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3中存在极性共价键 |
| B、稀有气体形成的单质没有化学键 |
| C、氯化钠中各离子均达到8电子稳定结构 |
| D、形成离子键的阴、阳离子间的作用力只存在静电吸引 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、m=
| ||
B、c=
| ||
C、ω=
| ||
D、c=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X有三种同位素 |
| B、其中一种同位素的原子质量数为81 |
| C、质量数为79的同位素,其原子质量分数为50% |
| D、X2的平均相对分子质量为159 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com