
A、m=
| ||
B、c=
| ||
C、ω=
| ||
D、c=
|
| 1000ρω |
| M |
| m |
| M |
| n |
| V |
| m |
| M |
| m(溶液) |
| ρ |
| ||
| ρ |
| m |
| ρω |
| m |
| 1000ρω |
| n(溶质) |
| V(溶液) |
| ||
|
| 1000ρω |
| M |
| 1000ρω |
| M |
| cM |
| 1000ρ |
| 100cM |
| 1000ρ |
| mg |
| Mg/mol |
| m |
| M |
| ||
| V×10-3L |
| 1000m |
| VM |


科目:高中化学 来源: 题型:
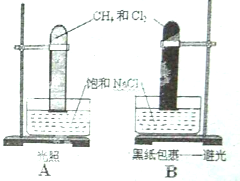 甲烷的取代反应实验(如图)CH4+Cl2→CH3Cl+HCl
甲烷的取代反应实验(如图)CH4+Cl2→CH3Cl+HCl查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“血液透析”利用了胶体的性质 |
| B、根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 |
| C、明矾[KAl(SO4)2?12H2O]净水是利用明矾与水反应生成Al(OH)3胶体,吸附了水中的悬浮物并沉降 |
| D、溶液一定是无色透明的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠的摩尔质量是40g |
| B、1mol NaOH的质量是40g/mol |
| C、1g H2和1g N2所含分子数相等 |
| D、等质量的N2、CH4、CO、H2O中CH4所含分子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
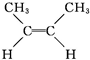 (g)?
(g)?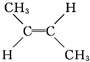 (g)△H=-4.2kJ?mol-1
(g)△H=-4.2kJ?mol-1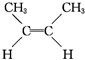 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.
(g)+H2(g)→CH3CH2CH2CH3(g)△H=-118.9kJ?mol-1.| A、顺-2-丁烯比反-2-丁烯稳定 |
| B、1 mol反-2-丁烯完全燃烧生成CO2和液态水所放出的热量比顺-2-丁烯的大 |
| C、28 g顺-2-丁烯完全氢化生成丁烷气体时所放出的热量为118.9 kJ |
D、反-2-丁烯氢化的热化学方程式为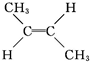 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 (g)+H2(g)→CH3CH2CH2CH3(g)△H=-112.7 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
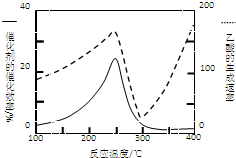 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究方向.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com