
【题目】近来,郑州大学药学院某研究小组合成出具有抗肿瘤活性的化合物X,其合成路线如下图所示:
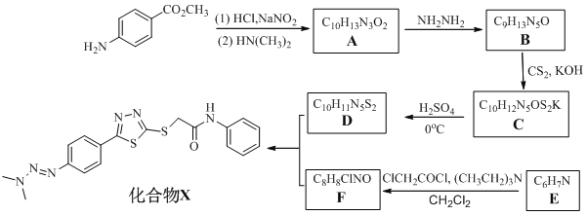
已知:
a.R-SH+R’Cl→RS-R’
b 
c 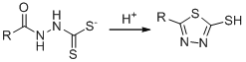
请回答:
(1)化合物F的结构简式_________________,推测E和ClCH2COCl反应得到化合物F的过程中, 二氯甲烷(CH2Cl2)是反应的溶剂,那(CH3CH2)3N的作用是_________________。
(2)下列说法正确的是___________________。
A. 化合物D可与钠反应
B. 上述生成B、F、化合物X的反应均为取代反应
C. 1 mol 化合物B可以与5 mol H2发生加成反应
D. 化合物X分子式为C18H18N6OS2
(3)A→B的化学方程式为__________________________________。
(4)写出同时符合下列条件的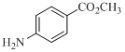 的同分异构体的结构简式:______________。
的同分异构体的结构简式:______________。
①红外光谱显示分子中含有一个甲基,1H-NMR谱图显示苯环上有两种化学环境的氢;
②分子能水解,且能发生银镜反应
(5)设计以甲苯、甲醇为原料合成化合物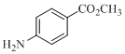 (用流程图表示,无机试剂任选)________________________________。
(用流程图表示,无机试剂任选)________________________________。
【答案】![]() 三乙胺中和反应得到的HCl ABD
三乙胺中和反应得到的HCl ABD 
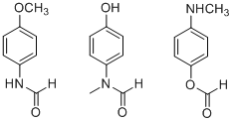
【解析】
X由D、F反应得到,根据题给信息中a反应及D、F的分子式分析得,D为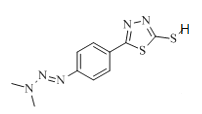 ,F为
,F为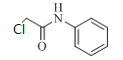 ;E与ClCH2COCl反应生成F,则E为
;E与ClCH2COCl反应生成F,则E为![]() ;根据C到D的反应条件及分子式的变化,结合题给信息中c反应知,C为
;根据C到D的反应条件及分子式的变化,结合题给信息中c反应知,C为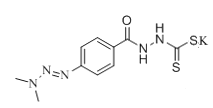 ;根据B的分子式及生成C的条件分析,B为
;根据B的分子式及生成C的条件分析,B为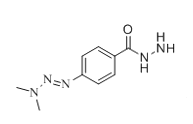 ;A与NH2NH2反应生成B,结合A的分子式分析A为
;A与NH2NH2反应生成B,结合A的分子式分析A为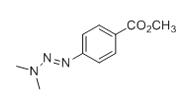 。
。
(1)X由D、F反应得到,根据题给信息中a反应及D、F的分子式分析得,D为 ,F为
,F为 ;E与ClCH2COCl反应生成F,则E为
;E与ClCH2COCl反应生成F,则E为![]() ,同时生成HCl,则(CH3CH2)3N的作用是中和反应生成的HCl;故答案为:
,同时生成HCl,则(CH3CH2)3N的作用是中和反应生成的HCl;故答案为:![]() ;中和反应生成的HCl;
;中和反应生成的HCl;
(2)A. 化合物D为 ,其中含有硫醇基-SH,可以与钠反应,故A正确;
,其中含有硫醇基-SH,可以与钠反应,故A正确;
B. 比较反应物和生成物的结构变化,可以知上述生成B、F、化合物X的反应均为取代反应,故B正确;
C. B为 ,结构中N=N键和苯环中的碳碳键均可以与氢气加成,而C=O键不能加成,则1 mol 化合物B可以与4 mol H2发生加成反应,故C错误;
,结构中N=N键和苯环中的碳碳键均可以与氢气加成,而C=O键不能加成,则1 mol 化合物B可以与4 mol H2发生加成反应,故C错误;
D. 根据X的结构分析X分子式为C18H18N6OS2,故D正确;故答案为:ABD;
(3)根据上述分析,A→B的化学方程式为 ,故答案为:
,故答案为: ;
;
(4)①红外光谱显示分子中含有一个甲基,
②分子能水解,且能发生银镜反应,取代基中有醛基和肽键或酯基,故结构简式为: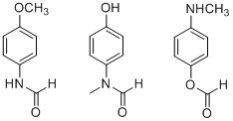 ,故答案为:
,故答案为: ;
;
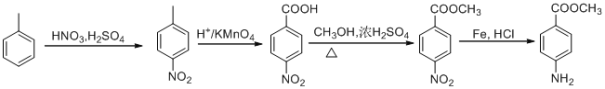
(5)根据题给信息中c反应,结合目标产物和原料的结构逆分析得,产物可由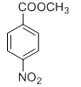 还原得到,而
还原得到,而 可由
可由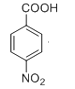 发生酯化反应得到,而对硝基苯甲酸可由对硝基甲苯氧化得到,对硝基甲苯可由甲苯在浓硫酸作用下与浓硝酸发生硝化反应得到,故合成路线为:
发生酯化反应得到,而对硝基苯甲酸可由对硝基甲苯氧化得到,对硝基甲苯可由甲苯在浓硫酸作用下与浓硝酸发生硝化反应得到,故合成路线为: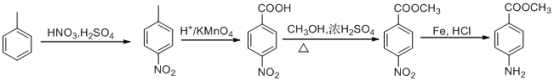 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】合成气(CO+H2)可利用甲烷与水蒸气重整反应制得。
(1)已知:①H2(g)+![]() O2(g)=H2O(g) △H1=-242kJmol-1
O2(g)=H2O(g) △H1=-242kJmol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJmol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802.6KJmo1-1
则甲烷和水蒸气重整反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H4=____。该反应的活化能E1=240.1kJmol-1,则逆反应的活化能E2=____。
CO(g)+3H2(g)△H4=____。该反应的活化能E1=240.1kJmol-1,则逆反应的活化能E2=____。
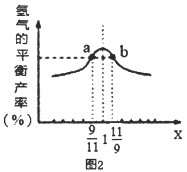
(2)重整反应中CH4的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图1所示。
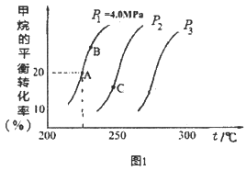
①图中A点的平衡常数KP=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),比较A、B、C三点的平衡常数Kp(A)、KP(B)、KP(C)由大到小的顺序为___。
②图中压强P1、P2、P3由大到小的顺序为___,理由是____。
(3)在恒容密闭容器中充入2mol的CH4和H2O(曲混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图2所示。请比较a、b两点CH4的转化率a点___b点(填“>”、“<”、“=”下同),a点c(CH4)___b点c[H2O(g)]。当x=1时,下列叙述正确的是____(填序号)。
A.平衡常数K最大 B.CH4的转化率最大
C.氢气的产率最大 D.合成气的浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为__________。
②NO3-的空间构型是____________________________________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为________。
②1 mol CO2中含有的σ键数目为____________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在生产生活中都具有重要的作用和意义。
(1)图1为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图,该电池的负极反应式为_________。

(2)制备焦亚硫酸钠(Na2S2O5)可采用三室膜电解技术,装置如图2所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_______。电解后,____室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
(3)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2,电解时发生反应的化学方程式为________________。溶液X中大量存在的阴离子有________________。

(4)测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸。将一定量的混合气体通入混合溶液中充分吸收。
Ⅱ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),以淀粉溶液为指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。
①锥形瓶内ClO2与碘化钾反应的离子方程式为__________________。
②测得混合气中ClO2的质量为______。
③测定混合气中ClO2的含量的操作中可能使测定结果偏低的是____(填字母)。
a.滴定管未润洗就直接注入硫代硫酸钠标准液
b.滴定管读取标准液体积时,开始仰视读数,滴定结束时俯视读数
c.锥形瓶用蒸馏水洗净后没有干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
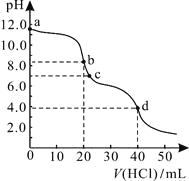
A. a点溶液呈碱性的原因用离子方程式表示为:CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. c点处的溶液中c(Na+)-c(Cl-)=c(HCO![]() )+2c(CO
)+2c(CO![]() )
)
C. 滴定过程中使用甲基橙作为指示剂比酚酞更准确
D. d点处溶液中水电离出的c(H+)大于b点处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4 溶液与Na2CO3 溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
(沉淀制备)称取 12.5 g 胆矾溶于 87.4 mL 蒸馏水中,滴 4 滴稀硫酸,充分搅拌后得到 CuSO4 溶液。向其中加入适 量 Na2CO3 溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是______________________。所得硫酸铜溶液的溶质质量分数约 为______________________。
(2)用无水乙醇洗涤的目的是______________________。
(实验探究)同学们设计了如下装置,用制得的蓝绿色固体进行实验:
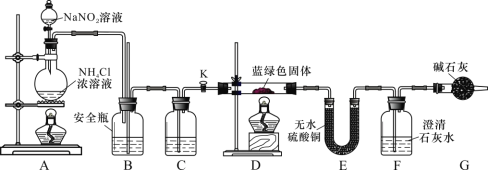
(3)D 装置加热前,需要首先打开活塞 K,用 A 装置制取适量 N2,然后关闭 K,点燃 D 处酒精灯。A 中产生N2 的作用是______________________,C 中盛装的试剂应是______________________。
(4)装置 A 中发生反应的离子方程式为______________________。
(5)若蓝绿色固体的组成为 xCuCO3·yCu(OH)2,实验能观察到的现象是_______________________________________。
(6)同学们查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用 Ba(OH)2 代替 Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是 ______________。
a.Ba(OH)2 的碱性比 Ca(OH)2 强
b.Ba(OH)2 溶解度大于 Ca(OH)2,能充分吸收 CO2;
c.相同条件下,CaCO3 的溶解度明显大于 BaCO3
d.吸收等量 CO2 生成的 BaCO3 的质量大于 CaCO3,测量误差小
待 D 中反应完全后,打开活塞 K,再次滴加 NaNO2 溶液产生 N2,其目的是 ________________________________________。若定量分析所取蓝绿色固体质量为 27.1 g,装置 F 中使用 Ba(OH)2 溶液,实验结束后, 装置 E 的质量增加 2.7 g,F 中产生沉淀 19.7 g。则该蓝绿色固体的化学式为 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是( )
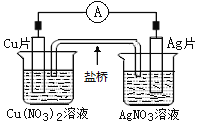
A.电子沿导线由Cu片流向Ag片
B.盐桥中的K+向Cu(NO3)2溶液
C.正极的电极反应是Ag++e-=Ag
D.Cu片上发生氧化反应,Ag片上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgSCN(白色,s)![]() Ag+(aq)+SCN-(aq),T℃时,Ksp(AgSCN)=1.0×10-12。在T℃时,向体积为20.00mL、浓度为mmol/L的AgNO3溶液中滴加0.l0mol/LKSCN溶液,溶液pAg的与加入的KSCN溶液体积的关系如图所示,下列说法错误的是( )
Ag+(aq)+SCN-(aq),T℃时,Ksp(AgSCN)=1.0×10-12。在T℃时,向体积为20.00mL、浓度为mmol/L的AgNO3溶液中滴加0.l0mol/LKSCN溶液,溶液pAg的与加入的KSCN溶液体积的关系如图所示,下列说法错误的是( )
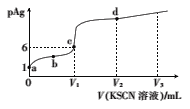
A.m=0.1
B.c点对应的KSCN溶液的体积为20.00mL
C.a、b、c、d点对应的溶液中水的电离程度:a>b>c>d
D.若V3=60mL,则反应后溶液的pAg=11-lg2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6 mol A气体和5 mol B气体混合充入4 L 密闭容器中,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),经5 s达到平衡,此时生成C为2 mol ,测得D的平均反应速率为0.1 mol·L-1·s-1,下列说法错误的是( )
2C(g)+xD(g),经5 s达到平衡,此时生成C为2 mol ,测得D的平均反应速率为0.1 mol·L-1·s-1,下列说法错误的是( )
A. x=2B. B的转化率为20%
C. 平衡时A的浓度为0.75 mol·L-1D. 恒温达到平衡时容器内的压强为开始的75%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com