
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为__________。
②NO3-的空间构型是____________________________________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为________。
②1 mol CO2中含有的σ键数目为____________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______________。
【答案】1s22s22p63s23p63d5(或[Ar]3d5) 平面三角形 C≡O 2×6.02×1023(或2NA) 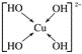 (或
(或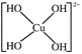 )
)
【解析】
(1)①Mn的原子序数为25,根据能量最低原理可写出Mn的基态原子的电子排布式,进而可确定Mn2+基态的电子排布式;②利用价层电子对互斥模型判断;
(2)①根据N2与CO为等电子体,结合等电子体结构相似判断;②据CO2的结构式O=C=O判断;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键。
(1)①Mn的原子序数为25,基态原子的电子排布式为1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),故答案为:1s22s22p63s23p63d5(或[Ar]3d5);
②NO3-中N原子形成3个δ键,没有孤电子对,则应为平面三角形,故答案为:平面三角形;
(2)①N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O,故答案为:C≡O;
②CO2的结构式为O=C=O,分子中C形成2个δ键,则1molCO2中含有的σ键数目为2×6.02×1023个,故答案为:2×6.02×1023(或2NA);
(3)[Cu(OH)4]2-中Cu2+与4个OH-形成配位键,则[Cu(OH)4]2-的结构可用示意图表示为: ,故答案为:
,故答案为: 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒、禽流感病毒)、细菌、真菌及芽孢。下面是市售过氧乙酸商品标签:

有关资料:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂。过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH)。CH3COOOH容易放出氧原子,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
(1)某研究性学习小组为了弄清配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?进行以下科学探究,请你完成下列相关内容:
①提出假设:甲溶液的主要成分为_________,乙溶液的主要成分为_________。
②实验验证:取甲、乙两种溶液少许,分别加入几滴_________试液,若①中假设正确,则甲溶液的现象为_____________________,乙溶液的现象为__________。
(2)有关过氧乙酸的叙述正确的是_________ (填编号)
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸与苯酚混合使用可增强消毒效果
C.过氧乙酸与乙酸属于同系物
D.氧元素的化合价为-2价
(3)实验室制备少量过氧乙酸,可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃至反应结束。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。
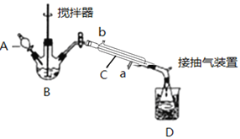
请回答下列问题:
①仪器C的名称是_______________;
②为更好地控制反应温度,应采用方法是_________________;
③生成过氧乙酸的化学方程式为________________________________________;
④碘量法取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KMnO4溶液至恰好粉红色以除去残余H2O2,再加入10mL 10%KI溶液和几滴淀粉溶液,摇匀,反应完全后再用0.1000mol/L的Na2S2O3标准液滴定至终点(反应方程式为2Na2S2O3+I2=Na2S4O6+2NaI),共消耗14.30mL Na2S2O3标准液。该样品中过氧乙酸的物质的量浓度是_____mol/L。(结果保留小数点后两位)(提示:CH3COOOH+2I+2H+ =I2+CH3COOH +H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应中的能量变化,下列说法中不正确的是( )
A. 燃烧反应都是放热反应
B. 对于可逆反应:aA(g)+bB(g)![]() bC(g)+dD(g),如果正反应放热,逆反应一定吸热
bC(g)+dD(g),如果正反应放热,逆反应一定吸热
C. 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量
D. 只有放热的氧化还原反应才可以设计为原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁,可以将其变废为宝。将废弃的线路板粉碎,经处理后可以得到粗铜(75%Cu、20%Al、4%Fe及少量Au、Pt),进一步制取胆矾,流程简图如下:
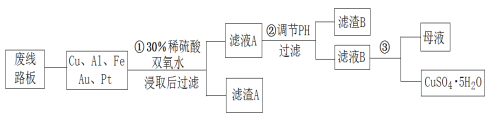
(1)滤渣A的成分主要是_____________。
(2)步骤①中溶解Cu的化学方程式是_________________,用______替代双氧水,加热,同样可以达到目的。
(3)步骤②调节溶液pH的目的是__________,可选用的最佳试剂是___。(写出一种即可)
(4)以石墨作电极电解滤液B,电解方程式是___________________。
(5)对以上粗铜进行电解精炼,下列说法正确的是_________。
A.电能全部转化为化学能
B.粗铜接电源正极,发生氧化反应
C.溶液中Cu2+的浓度保持不变
D.阳极泥中可回收Pt、Au等金属
(6)取128Kg粗铜利用上述流程制得CuSO4·5H2O的质量为326.25Kg,则CuSO4·5H2O的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
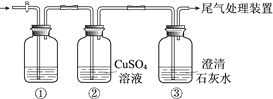
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A.③中白色浑浊是CaCO3
B.②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C.实验Ⅰ①中发生的反应是:CO2+H2O+ S2== CO32+ H2S
D.由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。

下列叙述正确的是
A. 曲线N表示pOH与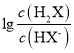 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近来,郑州大学药学院某研究小组合成出具有抗肿瘤活性的化合物X,其合成路线如下图所示:
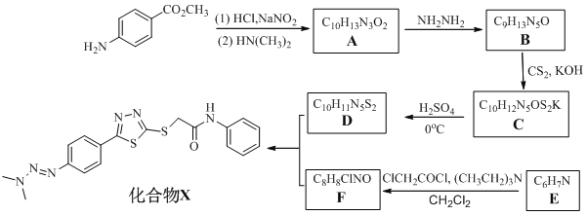
已知:
a.R-SH+R’Cl→RS-R’
b 
c 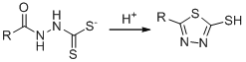
请回答:
(1)化合物F的结构简式_________________,推测E和ClCH2COCl反应得到化合物F的过程中, 二氯甲烷(CH2Cl2)是反应的溶剂,那(CH3CH2)3N的作用是_________________。
(2)下列说法正确的是___________________。
A. 化合物D可与钠反应
B. 上述生成B、F、化合物X的反应均为取代反应
C. 1 mol 化合物B可以与5 mol H2发生加成反应
D. 化合物X分子式为C18H18N6OS2
(3)A→B的化学方程式为__________________________________。
(4)写出同时符合下列条件的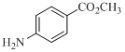 的同分异构体的结构简式:______________。
的同分异构体的结构简式:______________。
①红外光谱显示分子中含有一个甲基,1H-NMR谱图显示苯环上有两种化学环境的氢;
②分子能水解,且能发生银镜反应
(5)设计以甲苯、甲醇为原料合成化合物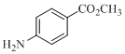 (用流程图表示,无机试剂任选)________________________________。
(用流程图表示,无机试剂任选)________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com