
| A、酸性强弱:H3PO4<H2SO4 |
| B、金属性强弱:K<Na |
| C、氧化性强弱:F2<Cl2 |
| D、碱性强弱:NaOH<Mg(OH)2 |


科目:高中化学 来源: 题型:
| A、5.04L |
| B、6.72L |
| C、20.16L |
| D、40.32L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=2 | B、pH=10 |
| C、pH=12 | D、pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、经加热发生的反应都是吸热反应 |
| B、放热反应不需要加热就能进行 |
| C、反应物的总能量高于生成物的总能量的反应属于放热反应 |
| D、上述都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
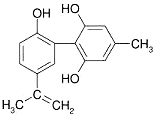 “人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是( )
“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是( )| A、该分子中的碳原子均为不饱和碳原子 |
| B、滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C、1mol该物质分别与浓溴水和H2反应,最多消耗Br2和H2的物质的量分别为4mol、7mol |
| D、遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑤③①④② |
| B、③⑤①②④ |
| C、②④③①⑤ |
| D、②④①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com