
����Ŀ��Ϊ��ȥ�����е�Ca2����Mg2����Fe3����SO42���Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£����ڳ������Լ��Թ�������
![]()
![]()
��1���ж�BaCl2�ѹ����ķ����� ��
��2���������У���صĻ�ѧ����ʽ�� ��
��3������NaCl��Һʱ�����������в���������ƫ����ƫ�ͣ�
A������ʱNaCl�ѳ��⣨ �� |
B����ƽ����������ʴ�� �� |
C������ҡ��ʱ��Һ���½��ּ�ˮ�� �� |
D������ʱ���ӿ̶��ߣ� �� |
���𰸡���1��ȡ����������ϲ���Һ1��2�Σ����ڵ�ΰ��ϣ��ٵ���1��2��BaCl2��Һ������Һδ����ǣ������BaCl2�ѹ�����
��2��CaCl2��Na2CO3==CaCO3����2NaCl��BaCl2��Na2CO3==BaCO3����2NaCl
��3��A.ƫ�� B��ƫ�� C��ƫ�� D��ƫ��
�������������������1��BaCl2�ѹ��������ټ��Ȼ����������ɳ�������ʵ�鷽��Ϊ���Թ�ȡ������������������ϲ���Һ���ٵ��뼸��BaCl2��Һ������Һδ����ǣ������BaCl2�ѹ������ʴ�Ϊ�����Թ�ȡ������������������ϲ���Һ���ٵ��뼸��BaCl2��Һ������Һδ����ǣ������BaCl2�ѹ�����
��2�����ε��ᴿ�У�����̼���Ƶ������dz�ȥ�������Ӹ������Լ������ı����ӣ���Ӧ�Ļ�ѧ����ʽΪCaCl2+Na2CO3=CaCO3��+2NaCl��BaCl2+Na2CO3=BaCO3��+2NaCl���ʴ�Ϊ��CaCl2+Na2CO3=CaCO3��+2NaCl��BaCl2+Na2CO3=BaCO3��+2NaCl��
��3��A������ʱ NaCl �ѳ��⣬��ʵ�ʳ����Ȼ�������ƫС��������ҺŨ��ƫ�ͣ��ʴ�Ϊ��ƫ�ͣ�
B����ƽ����������ʴ����ʵ�ʳ�����������ƫ������Ũ��ƫ�ʴ�Ϊ��ƫ�ߣ�
C������ҡ��ʱ��Һ���½��ּ�ˮ��������Һ���ƫ��Ũ��ƫС���ʴ�Ϊ��ƫ�ͣ�
D������ʱ���ӿ̶��ߣ�������Һ���ƫС��Ũ��ƫ�ʴ�Ϊ��ƫ�ߡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������Ҫ����0.2mol/L��NaCl��Һ950mL������ʱӦѡ�õ�����ƿ�Ĺ��ͳ�ȡ��NaCl�����ֱ����� ��
A��950mL��11.2g B��500mL��11.7g C��1000mL��11.7g D��������11.12g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NaOH��Һ��CuSO4��Һ����ij���˵���Һ�У���ʱ����۲쵽��ɫ��������˵���ò��˵���Һ�к���
A������ B���Ҵ� C���Ȼ��� D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2O2��ˮ��Ӧ�ܹ�����O2 �� ��һ��Ӧ�ں�����ߡ�DZˮͧ��̫�շɴ��п�Ϊ�����ṩ�������õ�O2������Ը÷�Ӧ��˵������ȷ���ǣ�������
A.����һ��������ԭ��Ӧ��Na2O2���������������ǻ�ԭ��
B.����һ��������ԭ��Ӧ��Na2O2����������ˮ�ǻ�ԭ��
C.����һ��������ԭ��Ӧ��Na2O2�ǻ�ԭ����ˮ��������
D.����һ���û���Ӧ���е���O2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���÷�Һ©�����Է����һ��������( )
A. ���CCl4 B. �����屽
C. ��������ˮ D. ���ͺͱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KNO3������Ʒ�к���������KCl��BaCl2���ʣ�Ϊ���ᴿKNO3������õ�BaCl2����������ʵ�������
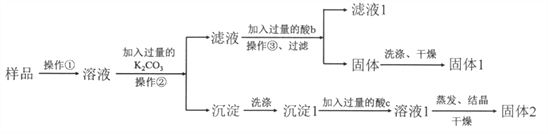
��1���Լ�c�Ļ�ѧʽ��_______������1�Ļ�ѧʽ��________���������K2CO3��������Ӧ�Ļ�ѧ����ʽΪ__________��
��2�������ͼ�����ʵ��ܽ�����߿�֪�����۵�������______��__________��
��ͬѧ��Ϊ������֮ǰ��������������b��Ҳ�ܵõ������Ĺ���1������Ϊ��ͬѧ�Ĺ۵��Ƿ���ȷ����������Ӧ����_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��ѡ��5���л���ѧ������
��Ⱦ�����Чȥ������Դ�ij�������ǻ�ѧ�츣�������Ҫ�о����⡣ij�о�С���������̿�(��Ҫ�ɷ�ΪMnO2��������������������ͭ�����Ƚ���������)���������ͨ�����¼����̼��ѳ�ȼúβ���е�SO2�����Ƶõ�ز���MnO2����Ӧ������ʡ�ԣ���

��ش��������⣺
(1)���������ж����Ƶ����˲�����ʵ���ҽ��й��˲���ʱ��Ҫ�õ��Ĺ����������в��������ձ���_______________�����в�������������___________________��
(2)��MnCO3�ܳ�ȥ��Һ�е�Al3+��Fe3+����ԭ����_____________(ֻ�����ֱ���)
(3)��ҵ�ϲ��õ��K2MnO4ˮ��Һ�ķ���������KMnO4�����ж��Ե缫��������������������д�������ĵ缫��Ӧʽ__________________��
(4)���и����Լ��У���ȷ�ⶨһ�����ȼúβ����SO2��������__________��(����)
a��NaOH��Һ����̪��Һ b��ϡH2SO4�ữ��KMnO4��Һ
c����ˮ��������Һ d����ˮ����̪��Һ
(5)������SO2��ϡ�����ữ�����̿�Ӧ�Ļ�ѧ����ʽΪ_______________����֪������SO2Ũ��Ϊ6.4g/m3�����̿�SO2�������ʿɴ�90%������1000m3ȼúβ�����ɵõ������̾���(MnSO4��H2O����Է�������Ϊ169)����Ϊ_________________kg(�������3 λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ��N2��g����O2��g����Ӧ����NO��g�������е������仯������ж�����˵����ȷ����
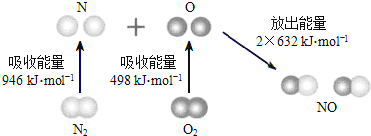
A��N2��g����O2��g����Ӧ����NO��g���Ƿ��ȷ�Ӧ
B��2molOԭ�ӽ������O2��g��ʱ��Ҫ�ų�498kJ����
C��1molNO��g�������еĻ�ѧ������ʱ��Ҫ�ų�632kJ����
D��N2��g����O2��g����2NO��g����H��+1444kJ/mol.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һƿ��ɫ�������Һ�����������������еļ�����ɣ�Na+��K+��NH4+��Fe2+��SO42����I����CO32����Cl����SO32����MnO4�������������ʵ�鲽�輰����ش����⣺
����һ��ȡ��������Һ������NaOH��Һ�����ȣ��õ���ҺA���������̼�����ζ������
�����������ҺA��������ϡ�����BaCl2��Һ���õ���ҺB����ɫ�������д̼�����ζ������
����������B��Һ��ͨ������Cl2���õ��ƺ�ɫ��ҺC
��1�������йظ���Һ˵����ȷ����__________��
A. һ������SO42����I����NH4+��SO32��
B. һ��������Fe2+��CO32����MnO4��
C. ���ܴ���CO32����Cl����Na+��K+
D. ����AgNO3��Һȷ��ԭ��Һ���Ƿ����Cl��
��2���������õ��ƺ�ɫ��Һ�����ӷ���ʽ��____________��
��3������ԭ��Һ���ȼ������������ᣬ�ټ���������________���ѧʽ�������ȣ�ͨ������Ҳ�ܵó�����һ������ͬ�Ľ��ۡ�
��4��������Һ�л����ܴ��ڵ������ӣ�ȷ������ڵ�ʵ�鷽����__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com