
【题目】将NaOH溶液与CuSO4溶液加入某病人的尿液中,微热时如果观察到红色沉淀,则说明该病人的尿液中含有
A.乙酸 B.乙醇 C.氯化钠 D.葡萄糖
科目:高中化学 来源: 题型:
【题目】硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易水解,易被氧化。某研究小组设计SnSO4制备路线如下:
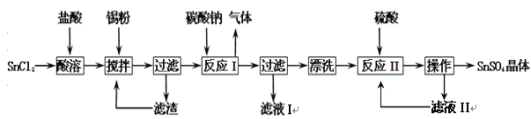
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,这样操作的原因是 ;
(2)反应I得到的沉淀是SnO,得到该沉淀的离子方程式是 ;
(3)在反应I得到沉淀SnO后,要进行“过滤”、“漂洗”,检验SnO是否洗涤干净的操作是 ;
(4)反应II之后的“操作”依次为 、 、过滤、洗涤、低温干燥;
(5)某化学兴趣小组对用于微电子器件生产的锡粉进行了纯度测定:①取1.19 g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;②加入过量的Fe2(SO4)3溶液;③用0.2000 mol/L 酸性K2Cr2O7溶液滴定(产物中Cr呈+3价)至终点,消耗K2Cr2O7溶液15.00 mL。写出酸性K2Cr2O7溶液滴定的离子方程式 ,则此锡粉样品中锡的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定密闭容器中发生反应H2(g)+I2(g) ![]() 2HI(g), 下列说法能说明此反应已经达到平衡状态的是
2HI(g), 下列说法能说明此反应已经达到平衡状态的是
A.容器内每减少1mol I2,同时生产2mol HI
B.容器内气体压强不再变化
C.混合气体的颜色不再变化
D.混合气体的密度恒定不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn), 发生反应:Sn(s)+Pb2+(aq) ![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是
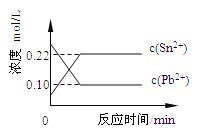
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 可燃冰开采属于新能源的利用 B. MgO可作耐火材料
C. 晶体硅大量用于电子信息技术 D. 在含Br2的水溶液中,可用热空气吹出Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
![]()
(1)判断BaCl2已过量的方法是 。
(2)第④步中,相关的化学方程式是 。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解( ) |
B.天平的砝码已锈蚀( ) |
C.定容摇匀时,液面下降又加水( ) |
D.定容时俯视刻度线( ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
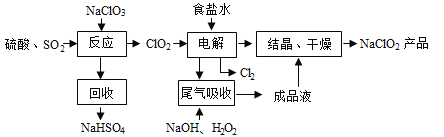
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式___________________。
(3)“电解”中阴极反应的主要产物是____________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为______________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________________。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com