
����Ŀ������ѧ��ѡ��5���л���ѧ������
��Ⱦ�����Чȥ������Դ�ij�������ǻ�ѧ�츣�������Ҫ�о����⡣ij�о�С���������̿�(��Ҫ�ɷ�ΪMnO2��������������������ͭ�����Ƚ���������)���������ͨ�����¼����̼��ѳ�ȼúβ���е�SO2�����Ƶõ�ز���MnO2����Ӧ������ʡ�ԣ���

��ش��������⣺
(1)���������ж����Ƶ����˲�����ʵ���ҽ��й��˲���ʱ��Ҫ�õ��Ĺ����������в��������ձ���_______________�����в�������������___________________��
(2)��MnCO3�ܳ�ȥ��Һ�е�Al3+��Fe3+����ԭ����_____________(ֻ�����ֱ���)
(3)��ҵ�ϲ��õ��K2MnO4ˮ��Һ�ķ���������KMnO4�����ж��Ե缫��������������������д�������ĵ缫��Ӧʽ__________________��
(4)���и����Լ��У���ȷ�ⶨһ�����ȼúβ����SO2��������__________��(����)
a��NaOH��Һ����̪��Һ b��ϡH2SO4�ữ��KMnO4��Һ
c����ˮ��������Һ d����ˮ����̪��Һ
(5)������SO2��ϡ�����ữ�����̿�Ӧ�Ļ�ѧ����ʽΪ_______________����֪������SO2Ũ��Ϊ6.4g/m3�����̿�SO2�������ʿɴ�90%������1000m3ȼúβ�����ɵõ������̾���(MnSO4��H2O����Է�������Ϊ169)����Ϊ_________________kg(�������3 λ��Ч����)��
���𰸡���1��©����2�֣� ��������ֹҺ�彦����2�֣�
��2��������Һ�е��ᣬ�ٽ�Al3+��Fe3+ˮ�������������������2�֣�
��3��MnO42����e���TMnO4����2�֣� ��4��bc��2�֣�
��5��SO2+MnO2=MnSO4��3�֣� 15.2��2�֣�
��������
�����������1�����˲�����Ҫ�ձ���©�����������������ֲ����������ǹ��������������в���������������������ֹҺ�彦�������á�
��2����������������ˮ������������������������������ӣ�����MnCO3��������Һ�е��ᣬ�ٽ�Al3+��Fe3+ˮ�������������������
��3����������������������Ӧ��Ԫ�صĻ��ϼ����ߣ���MnO42-������ΪMnO4-�����������ĵ缫��ӦʽΪMnO42����e���TMnO4����
��4��a.��������������������Һ��Ӧ�����ɵ��������ƻ����������ƻ���ߵĻ������������ȷ�������Բ��ܼ����������ĺ���������b.�������������Ը��������Һ����������ԭ��Ӧ����Ӧֻ��һ��������̶������Կ���ȷ�����������ĺ�������ȷ��c.������������ۡ���ˮ��Һ����������ԭ��Ӧ������̶������������ԣ�����ȷ�����������ĺ�������ȷ��d.��ˮ��������Һ�����������Ӧ�IJ��������������李���������李����߶��ߵĻ������ﲻ�̶������Բ���ȷ�����������ĺ���������ѡbc��
��5��SO2��ϡ�����ữ�����̿���������ԭ��Ӧ���������̣���Ӧ����ʽΪSO2+MnO2=MnSO4������ԭ���غ㣬�����յ�SO2 �����ʵ������������̾�������ʵ������������̾��������Ϊ��1000m3��6.4 g/m3��90%����64g/mol��169g/mol=15.2 kg��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ��ܱ������з�����ӦH2��g��+I2��g�� ![]() 2HI��g��, ����˵����˵���˷�Ӧ�Ѿ��ﵽƽ��״̬����
2HI��g��, ����˵����˵���˷�Ӧ�Ѿ��ﵽƽ��״̬����
A��������ÿ����1mol I2��ͬʱ����2mol HI
B������������ѹǿ���ٱ仯
C������������ɫ���ٱ仯
D�����������ܶȺ㶨����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йغϽ����;��Ӧ���˺Ͻ����Щ���ʣ�
���ø������е
��
����Ӳ������ɻ�
��
�۲������е
��
����ºϽ��Ʒ�����ȫװ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȥ�����е�Ca2����Mg2����Fe3����SO42���Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£����ڳ������Լ��Թ�������
![]()
![]()
��1���ж�BaCl2�ѹ����ķ����� ��
��2���������У���صĻ�ѧ����ʽ�� ��
��3������NaCl��Һʱ�����������в���������ƫ����ƫ�ͣ�
A������ʱNaCl�ѳ��⣨ �� |
B����ƽ����������ʴ�� �� |
C������ҡ��ʱ��Һ���½��ּ�ˮ�� �� |
D������ʱ���ӿ̶��ߣ� �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʫ���ǹ���Ϊ�������µı�����Ƹ�������ʫ����ֻ�漰�����仯����
A. Ұ���ղ����� ���紵����
B. ���ϵ���˿������ ����ɻ���ʼ��
C. ֻҪ����� ����ĥ����
D. ��������һ����� ������ů������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������������ֽ�Ϊ̼���ơ��ּ���5.00g��̼���ƺ�̼�����ƵĻ���ʹ̼��������ȫ�ֽ⣬���������������0.31g����������̼���Ƶ�����Ϊ��������
A.3.38g
B.4.58g
C.4.16g
D.4.41g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��X����ѧ���������������ͼת����ϵ(����������ͷ�Ӧ������ȥ)��
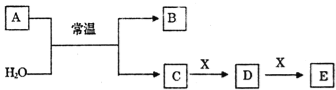
(1)��AΪ�����Ľ������ʣ���ɫ��Ӧ�ʻ�ɫ��X��ʹƷ����Һ��ɫ��д��C��E��Ӧ�����ӷ���ʽ��__________________��
(2)��AΪ������Ԫ����ɵĵ��ʣ���Ԫ�ص�����������ˮ����������ǿ����
����ɵ���A��Ԫ�������ڱ��е�λ��Ϊ______________.
��X����Ϊ__________������ţ���
a��NaHCO3 b��Na2CO3 c��Na2SO3 d��Al(OH)3
(3)��AΪ����ɫ��ĩ���ش��������⣺
��1molA��������H2O��ַ�Ӧʱת�Ƶĵ�����ĿΪ__________��
��A�������еĻ�ѧ������Ϊ___________________��
����XΪһ���������ЧӦ�����壮������Ũ�ȵ�D��E������Һ����ѡ����Լ�Ϊ__________������ţ���
a������ b��BaCl2��Һ c��NaOH��Һ d��Ca(OH)2��Һ
(4)��AΪ�����X��Fe����ҺD�м���KSCN��Һ��졣��A��H2O��Ӧ�Ļ�ѧ��Ӧ����ʽΪ______________��E��________________(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
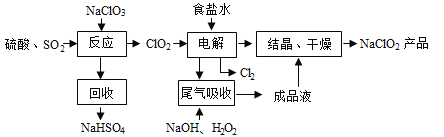
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ�������������£�
�ش��������⣺
��1��NaClO2��Cl�Ļ��ϼ�Ϊ_______��
��2��д������Ӧ������������ClO2�Ļ�ѧ����ʽ___________________��
��3������⡱��������Ӧ����Ҫ������____________��
��4����β�����ա������ա���⡱�����ų�������ClO2�������շ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ______________��
��5������Ч�Ⱥ��������������������������������������䶨���ǣ�ÿ�˺��������������������൱�ڶ��ٿ�Cl2������������NaClO2����Ч�Ⱥ���Ϊ________________��(������������λС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����˺��ʳ��ˮ����Ȼ���п����Ե�CaCl2��MgCl2��Na2SO4�����ʣ�ͨ�����¼���ʵ�鲽�裬���Ƶô�����ʳ��ˮ���������Թ�����Na2CO3��Һ���������Թ�����NaOH��Һ���������Թ�����BaCl2��Һ��������ϡ�����������ݲ�������������ȷ�IJ���˳��Ϊ
A���ۢڢ٢ݢ�
B���٢ڢۢݢ�
C���ڢۢ٢ܢ�
D���ۢݢڢ٢�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com