
【题目】下列说法正确的是
①新制氯水经光照一段时间pH减小
②Al和Fe都可以利用致密的氧化膜保护内层金属不被腐蚀
③Al2O3和Fe2O3都为碱性氧化物,所以都能溶于硫酸
④pH在5.6~7.0之间的降水通常称为酸雨
A. ①② B. ②③ C. ①③ D. ③④
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】大多数物质的俗名是根据其特殊的物理性质或用途得来的。下列物质的俗名与化学式或用途不相符的一项是
选项 | 俗名 | 主要成分(化学式) | 用途 |
A | 石英 | SiO2 | 集成电路 |
B | 纯碱 | Na2CO3 | 制备玻璃 |
C | 水玻璃 | Na2SiO3 | 制备硅胶 |
D | 铁红 | Fe2O3 | 用作油漆和涂料 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是
A. 溶液中![]() 不变
不变
B. 醋酸的电离程度增大,溶液中导电粒子的数目减少
C. 若稀释到pH=4,所需水的体积等于90mL
D. 再加入10mLpH=11的NaOH溶液,混合后溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑化剂是一种对人体有害的物质。增塑剂DCHP可由邻苯二甲酸酐与环已醇反应制得。下列说法不正确的是

A. DCHP的分子式为C20H26O4
B. 该反应属于取代反应
C. DCHP的一氯取代产物有6种
D. 与环已醇分子式相同,且具有醛基(-CHO)的结构共有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料。利用CO2和 H2在催化剂的作用下合成甲醇,有关反应的反应热与平衡常数表示如下:
反应1:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H1 K1
CO(g)+H2O(g) △H1 K1
反应2:CO(g)+2H2(g) ![]() CH3OH(g) △H2 K2
CH3OH(g) △H2 K2
总反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3 K3
CH3OH(g)+H2O(g) △H3 K3
(1)①△H3=_________(用△H1、△H2表示)。
②K3 =____________(用K1、K2表示)。
③在恒温恒容的密闭容器中,能判断总反应达平衡状态的依据是______(填番号)。
a.容器中的压强保持不变
b.H2的质量分数保持不变
c.有两个C=O键断裂的同时水分子中有两个H-O键断裂
d.化学平衡常数K保持不变
e.c(CO2) =c(H2O)
f.速率v (CO2) =v(H2O)
④在某温度下,反应体系达平衡时,增大体系的压强,体系中,反应1的平衡______移动(填“向正反应方向”、“向逆反应方向”和“不”)。
(2)以上平衡常数随温度变化的曲线如图所示:
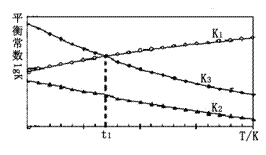
①则△H2_____△H3(填“大于”、“小于”或“等于”),理由是______________。
②温度为t1时,体系建立起化学平衡状态,测得c(H2)=0.1 mol·L-1 ,c(CH3OH):c(CO)=________。
(3)甲醇可用于制取氰化氢。已知:Ka(HCN) = 6.0×10-10,Kw=1×10-14氰化钠水解的离子方程式为CN-+H2O![]() HCN+OH-。
HCN+OH-。
①该水解反的平衡常数的值Kh=_________。
②一种由等物质的量浓度的NaCN和HCN组成的缓冲溶液,该溶液的pH____7 (“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某实验室需要配制480 mL 0.10 mol/L Na2CO3溶液。

①所需玻璃仪器有:玻璃棒、烧杯、100mL量筒、______________________。
②实验时图中所示操作的先后顺序为________________(填编号)
(2)现用质量分数为98℅、密度为1.84g/mL的浓硫酸来配制500mL 0.2mol/L 的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。完成下列问题:
①上述仪器中,在配制稀硫酸时不需要用到的是_______________________(填序号)
②经过计算,需要量取浓硫酸的体积为_______。今有①10mL ②50mL ③100mL 三种规格的量,你选用的规格是_________(填序号)
③配制操作可分解成如下几步,以下正确的操作顺序是____________________________
A、 向容量瓶中注入少量蒸馏水,检查是否漏水
B、 用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C、 用已冷却的稀硫酸注入已检查不漏水的100mL容量瓶中
D、 根据计算,用量筒量取一定体积的浓硫酸
E、 将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F、 盖上容量瓶塞子,振荡,摇匀
G、 用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H、 继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1-2 cm处
④在配制过程中,下列操作错误的是______,能使所配溶液浓度偏高的是______(填序号)
a.洗涤量取浓硫酸后的量筒,并将洗涤液转移至容量瓶中
b.未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
c.定容时,俯视刻度线
d.将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
e.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
f.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑤向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面将导致所配溶液浓度__________(填“偏高”、“偏低”或“无影响”),针对这种情况,你将如何处理_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是( )
A. 硅是良好的半导体材料,且是制造光缆的主要材料
B. SiO2不溶于水,也不溶于任何酸
C. 观察K2SO4的焰色应透过蓝色的钴玻璃
D. Fe在Cl2中燃烧生成FeCl3,故在与其它非金属反应的产物中Fe也显+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
早期发现的一种天然二十面体准晶颗粒由三种Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有_________个未成对电子,Fe3+的电子排布式为_______________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为_______________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为____________,乙醛分子中各元素的电负性由大到小的顺序为_______________。乙酸的沸点明显高于乙醛,其主要原因是_____________________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为__________。列式表示Al单质的密度_______________ g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:
2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)现代化学中,常利用_________上的特征谱线来鉴定元素
(2)试从分子的立体构型和原子的电负性、中心原子上的孤电子对等角度解释为什么与水结构十分相似的OF2的极性很小?______________________。
(3)己知H2S2O8的结构如图。
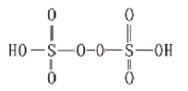
①H2S2O8硫原子的轨道杂化方式为________________。上述反应中被还原的元素为_____________。
②S基态原子中电子的空间运动状态有________________ 种。
③上述反应每生成1 mol MnO4-,S2O82-断裂的共价键类型及其数目为___________、__________。
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。
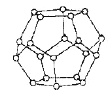
①如图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为__________;
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是__________。
(5)底心晶胞的特征是:将晶胞的框架的顶角移至晶胞的某一对面的中心所得的新晶胞与原晶胞无差别。在晶体学上底心平移的符号是+ (1/2,1/2,0) (C底心);或+ (0,1/2,1/2) (A底心);或+ (1/2,0,1/2) (B底心)。底心平移是指其中之一。

则:I2是_______(填“A”、“B”或“C”)底心晶胞.
(6)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图(a)所示,并给出了一个石墨的六方晶胞如图(b)所示。
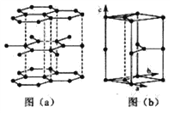
①在图中画出晶胞沿C轴的投影(用“●” 标出碳原子位置即可)_______________;
标出碳原子位置即可)_______________;
②假设石墨的层间距为300 pm。C-C键长为150 pm。计算石墨晶体的密度为______g· cm-3(碳元素的相对质量为12,NA=6.0×1023,计算结果保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com