
����Ŀ����A��B��D��E��F��G���ֶ����ڵ�����Ԫ�أ�A��ԭ�Ӱ뾶��С��B����������������������������2����B��D�г��ȼ����������ۻ�����BD2 �� E+��D2��������ͬ�ĵ��Ӳ�ṹ��G��Dͬ���壬A������F������ȼ�յIJ�������ˮ�õ�һ��ǿ��X����ش��������⣺
��1��BD2�ĽṹʽΪ ��
��2��GԪ����Ԫ�����ڱ��е�λ��Ϊ �� ��GD2���������Ƶ�F���ʵ�ˮ��Һ�����ӷ���ʽΪ ��
��3�������Ԫ���к�AԪ�صĶ�Ԫ���ӻ�����ĵ���ʽΪ �� D��E�γɵĻ��������DZˮ����еĹ���������û�������ˮ��Ӧ�����ӷ���ʽΪ ��
��4��A��B��D��Ԫ������ɵ�ijһԪ��Y���ճ������г�����һ�ֵ�ζ�����ڵ������Ũ�ȵ�X��Y��Һ�м�����״��ͬ��������п�������ߵ�ƽ����Ӧ���ʵĴ�С��ϵ��XY�������������=������
��5����A��D��E��G��Ԫ�ؿ��γ�������ʽ�Σ�����������ʽ����ˮ��Һ�з�Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1��O=C=O
��2���������ڵڢ�A�壻SO2+Cl2+2H2O=4H++2Cl��+SO42��
��3��![]() ��2Na2O2+2H2O=4Na++4OH��+O2��
��2Na2O2+2H2O=4Na++4OH��+O2��
��4����
��5��NaHSO3+NaHSO4=Na2SO4+SO2��+H2O
���������⣺A��B��D��E��F��G���ֶ����ڵ�����Ԫ�أ�A��ԭ�Ӱ뾶��С����AΪH��B����������������������������2������BΪC��S��B��D�г��ȼ������������ۻ�����BD2 �� ��DΪO��B���������Ϊ+4�ۣ���BΪC��E+��D2��������ͬ�ĵ���������EΪNa��A��F��ȼ�գ���������ˮ�õ�һ��ǿ�ᣬ��FΪCl����1��������BD2 �� Ϊ������̼����ṹʽΪ��O=C=O�� ���Դ��ǣ�O=C=O����2��SԪ��λ�����ڱ��ĵ������ڵ�VIA�壻SO2���л�ԭ�ԣ��������Ƶ���ˮ��Ӧ������������ᣬ�䷴Ӧ�����ӷ���ʽΪ��SO2+Cl2+2H2O=4H++2Cl��+SO42�������Դ��ǣ��������ڵ�VIA�壻SO2+Cl2+2H2O=4H++2Cl��+SO42������3��H����ý��������γ����ӻ�����NaH�������ʽΪ ![]() ��Na��������Ӧ���ɹ������ƣ�����������ˮ��Ӧ�����������ƺ��������䷴Ӧ�����ӷ���ʽΪ��2Na2O2+2H2O=4Na++4OH��+O2�������Դ��ǣ�
��Na��������Ӧ���ɹ������ƣ�����������ˮ��Ӧ�����������ƺ��������䷴Ӧ�����ӷ���ʽΪ��2Na2O2+2H2O=4Na++4OH��+O2�������Դ��ǣ� ![]() ��2Na2O2+2H2O=4Na++4OH��+O2������4��A��B��D��Ԫ������ɵ�ijһԪ��YΪCH3COOH��XΪ���ᣬ��������������Һ�в��ֵ��룬���ڵ������Ũ�ȵ�CH3COOH��HCl��Һ�У�������������Ũ��С�����Լ�����״��ͬ��������п���������ƽ����Ӧ����С�������ߵ�ƽ����Ӧ���ʵĴ�С��ϵ��X��Y��
��2Na2O2+2H2O=4Na++4OH��+O2������4��A��B��D��Ԫ������ɵ�ijһԪ��YΪCH3COOH��XΪ���ᣬ��������������Һ�в��ֵ��룬���ڵ������Ũ�ȵ�CH3COOH��HCl��Һ�У�������������Ũ��С�����Լ�����״��ͬ��������п���������ƽ����Ӧ����С�������ߵ�ƽ����Ӧ���ʵĴ�С��ϵ��X��Y��
���Դ��ǣ�������5����H��O��Na��S��Ԫ�ؿ��γ�������ʽ�Σ�NaHSO3��NaHSO4 �� ��������ʽ����ˮ��Һ�з�Ӧ����Na2SO4��SO2��ˮ���仯ѧ����ʽΪNaHSO3+NaHSO4=Na2SO4+SO2��+H2O�����Դ��ǣ�NaHSO3+NaHSO4=Na2SO4+SO2��+H2O��


 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���穁Fenton��������ˮ�����л���Ⱦ�オ��ĸ������������䷴Ӧԭ����ͼ��ʾ�����е�������H2O2��Fe2+����Fenton��Ӧ��Fe2++H2O2=Fe3++OH��+OH�����ɵ��������ɻ���OH�������������л���Ⱦ�����˵������ȷ���ǣ� �� 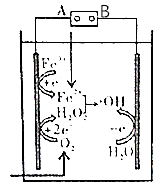
A.��Դ��A���Ǹ���
B.������ֻ��O2��Fe3+������ԭ��Ӧ
C.�����Ϸ����缫��Ӧ��H2O��e��=OH+H+ ��
D.����1molO2 �� ���Բ���4molOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е������ܴ���������ǣ� ��
A. H+��Na+��NO3-��SO32-B. NH4+��K+��Cl-��OH-
C. Fe3+��NH4+��NO3-��SO42-D. K+��Fe3+��SO32-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ŨH2SO4��˵����ȷ����
A.��һ����ɫճ��״��Һ��B.������ʹCu�����ۻ�
C.ʹ���DZ����������ˮ��D.�����ڸ��ﰱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����֪H2CO3H++HCO3��K1=4.3��l0��7��
HCO3��H++CO32��K2=5.6��l0��11��
H2OH++OH��Kw=1.0��l0��14
��ȡ10.6g Na2CO3�����������õ�һ�����Ϊ1L����Һ����Һ�в�������pH �Ĺ�ϵ��ͼ��ʾ�������й���Һ������Ũ�ȹ�ϵ������ȷ���ǣ�������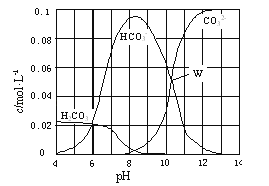
A.W����ʾ����Һ�У�c��Na+��+c��H+��=2c��CO32����+c��OH����+c��HCO3����
B.pH=4����Һ�У�c��H2CO3��+c��HCO3����+c��CO32����=0.1 molL��1
C.pH=8����Һ�У�c��H+��+c��H2CO3��+c��HCO3����=c��OH����+c��Cl����
D.pH=11����Һ�У�CO32��+H2OHCO3��+OH��K=1.8��l0��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��800��ʱ����2L���ܱ������з�����Ӧ��2NO��g��+O2��g��2NO2 �� n��NO����ʱ��ı仯�����ʾ��
ʱ��Ms | 0 | 1 | 2 | 3 | 4 | 5 |
n��NO���Mmol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����0��3s�ڣ���NO��ʾ��ƽ����Ӧ����v��NO��= ��
��2��ͼ�б�ʾNOŨ�ȱ仯��������������ĸ���ţ��� 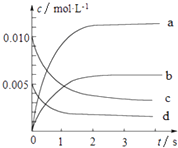
��3����ƽ��ʱNO��ת����Ϊ ��
��4����˵���÷�Ӧ�Ѵﵽƽ��״̬����������ţ��� A������������ɫ���ֲ���
B�����������ܶȱ��ֲ���
C��v�� ��NO2��=2v�� ��O2��
D����������ƽ����Է����������ֲ���
��5�������µ�850�棬��ƽ���n��NO��=n��NO2������Ӧ���������Ӧ�����淴Ӧ�����ƶ���
��6������һ��������0.2molNO������������Ӧ����ƽ��ʱ��÷ų�������ΪakJ����ʱNOת����Ϊ80%����2molNO������ȫ��Ӧ�ų�������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷ���Al2O3 �� ��������SiO2��Fe2O3��MgO����ҵ�ϴ�����������ȡ���ɲ�����ͼ��ʾ�������̣� 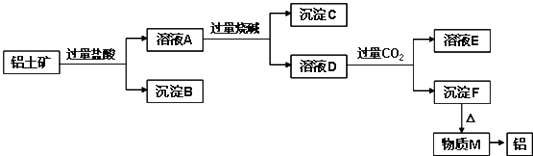
��ش��������⣺
��1��ͼ���漰������Һ�������ʵ�鷽��������������ƣ�����Ҫ�õ��IJ��� ��������
��2������B�ijɷ������ѧʽ����ͬ��������C�ijɷ�������
��3��д��������ҺD�����ӷ���ʽ��
��4������Fת��Ϊ����M�Ļ�ѧ����ʽΪ����ҺD��ͨ�����CO2���ɳ���F�����ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�ɷ���FeS2��ij���᳧�ڽ��л�����ɷֲⶨʱ��ȡ0.1000 g��Ʒ�ڿ����г�����գ������ɵ�SO2����������Fe2(SO4)3��Һ��ȫ��Ӧ����Ũ��Ϊ0.02000 mol��L��1��K2Cr2O7����Һ�ζ����յ㣬����K2Cr2O7����Һ25.00 mL��
��֪��SO2��2Fe3����2H2O=SO42-��2Fe2����4H��
Cr2O72-��6Fe2����14H��=2Cr3����6Fe3����7H2O
��1����Ʒ��FeS2������������(�������ʲ��μӷ�Ӧ) ��
��2��������6 g FeS2������SO2ȫ��ת��ΪSO3����ʱ�ų�9.83 kJ������������SO3��ˮȫ����������H2SO4 �� �ų�13.03 kJ������д��SO3����ת��ΪH2SO4���Ȼ�ѧ����ʽ?
��3������10 t���������������ϲ���SO2�����(��״��)ΪL���Ƶ�98%����������Ϊt��SO2ȫ��ת��ΪH2SO4ʱ�ų���������kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(PLA)�����л��ᡪ������Ϊԭ�����������;������ϣ�����ʤ���������Ͼ���ϩ���۱�ϩ���۱���ϩ�Ȳ��ϣ�����������߷�չǰ;�����Ͱ�װ���ϣ��ǻ�����װ�����е�һ�����ǡ��ձ��ӷĹ�˾������Ϊԭ�Ϸ������������ᣬ���þ������Ƴ����オ���Է��ݲ��ϡ��ò��ϵ�ǿ�ȡ������ԡ���ҩ�Ե���۱���ϩ������ͬ�������պ���Ⱦ���������ɷ������˵������ȷ����( )
A.������ʹ�ú��ܱ���Ȼ����������ȫ���⣬�������ɶ�����̼��ˮ������Ⱦ����
B.�����������ڴ��ܡ����ܵȸ��ּӹ��������ӹ����㣬Ӧ��ʮ�ֹ㷺
C.������(PLA)��һ����Ȼ�߷��ӡ��Ի����Ѻõľ�������
D.���������Ե��۷���(��ѧ�ϳ�)�õ��ģ�������Ϊ����ԭ���Ʊ���һ�־�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com