
【题目】在常温下,向20 mL浓度均为0.1 mol·L1的盐酸和氯化铵混合溶液中滴加0.1 mol·L1的氢氧化钠溶液,溶液pH随氢氧化钠溶液加入体积的变化如图所示(忽略溶液体积变化)。下列说法正确的是
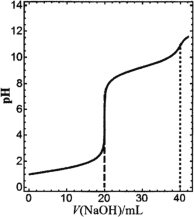
A.V(NaOH)=20 mL时,2n(![]() )+n(NH3·H2O)+n(H+)-n(OH)=0.1 mol
)+n(NH3·H2O)+n(H+)-n(OH)=0.1 mol
B.V(NaOH)=40 mL时,c(![]() )<c(OH)
)<c(OH)
C.当0<V(NaOH)<40 mL时,H2O的电离程度一直增大
D.若改用同浓度的氨水滴定原溶液,同样使溶液pH=7时所需氨水的体积比氢氧化钠溶液要小
【答案】B
【解析】
A. V(NaOH)=20 mL时,溶液中的溶质为0.02mol氯化钠和0.02mol氯化铵,电荷守恒有n(Na+)+n(H+)+ n(![]() )=n(Cl-)+n(OH),因为n(Na+)=0.02mol,n(Cl-)=0.04mol,所以有n(H+)+ n(
)=n(Cl-)+n(OH),因为n(Na+)=0.02mol,n(Cl-)=0.04mol,所以有n(H+)+ n(![]() )=0.02+n(OH),物料守恒有n(Cl-)= n(Na+)+ n(
)=0.02+n(OH),物料守恒有n(Cl-)= n(Na+)+ n(![]() )+n(NH3·H2O),即0.02= n(
)+n(NH3·H2O),即0.02= n(![]() )+n(NH3·H2O),所以,2n(
)+n(NH3·H2O),所以,2n(![]() )+n(NH3·H2O)+n(H+)=0.04 mol+n(OH),故错误;
)+n(NH3·H2O)+n(H+)=0.04 mol+n(OH),故错误;
B. V(NaOH)=40 mL时,溶质为0.04mol氯化钠和0.02mol一水合氨,溶液显碱性,因为水也能电离出氢氧根离子,故c(![]() )<c(OH)正确;
)<c(OH)正确;
C. 当0<V(NaOH)<40 mL过程中,前20毫升氢氧化钠是中和盐酸,水的电离程度增大,后20毫升是氯化铵和氢氧化钠反应,水的电离程度减小,故错误;
D. 盐酸和氢氧化钠反应生成氯化钠溶液,为中性,若改用同浓度的氨水滴定原溶液,盐酸和氨水反应后为氯化铵的溶液仍为酸性,所以同样使溶液pH=7时所需氨水的体积比氢氧化钠溶液要大,故错误。
故选B。


科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+ H2(g) 在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是 ( )
CO(g)+ H2(g) 在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是 ( )
A.增加H2O的物质的量浓度B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大D.保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
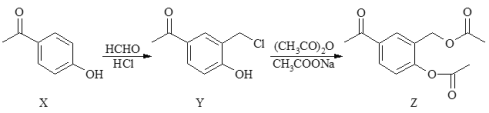
下列说法正确的是
A.X、Y、Z均属于芳香烃B.X分子中所有原子在同一平面上
C.可用FeCl3溶液鉴别Y和ZD.1 mol Z最多能与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用分类的方法和氧化还原反应的规律,能实现某些物质的转化。
(1)请从下列试剂中选择合适的试剂完成指定转化(试剂可以重复选择)。
试剂:Cl2、HCl、Na2S、H2O;
①I2→IO3-的离子方程式:____;
②CuSO4→Na2SO4的化学方程式:_____。
(2)利用水钴矿(主要成分是Co2O3,含少量Fe2O3、Al2O3)制取CoC2O4·2H2O的流程如下:
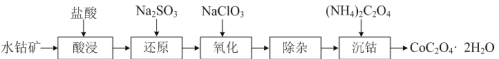
①“还原”时,Fe3+和Co3+均被还原为正二价阳离子,写出Co3+被还原的离子方程式_。
②“氧化”反应的离子方程式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在锂电池发展上做出贡献的三位科学家。某可连续工作的液流锂离子储能电池放电时工作原理如图所示,下列说法正确的是
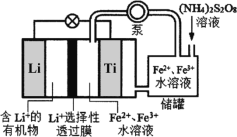
A.放电时,储罐中发生反应:S2O82-+2Fe2+=2Fe3++2SO42-
B.放电时,Li电极发生了还原反应
C.放电时,Ti电极发生的电极方程式为:Fe2+-e=Fe3+
D.Li+选择性透过膜可以通过Li+和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素在化学领域具有重要的地位。请回答下列问题:
(1)基态氮原子的价电子轨道表示式为___________;第二周期的元素中,第一电离能介于B和N之间的元素有___________种。
(2)雌黄的分子式为As2S3,其分子结构如图所示:![]() As原子的杂化类型为___________。
As原子的杂化类型为___________。
(3)①向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加入一定量的乙醇,析出[Cu(NH3)4]SO4·H2O固体。SO42-的空间构型为___________;[Cu(NH3)4]SO4·H2O固体中含有的化学键有___________(填标号)。
A.离子键 B.共价键 C.氢键 D.金属键 E.配位键
若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是进行___________实验。
②已知NF3与NH3分子的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,原因是___________。
(4)大π键可用![]() 表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为
表示,其中n、m分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为![]() 。N2O分子中的大π键表示为_________________。
。N2O分子中的大π键表示为_________________。
(5)立方氮化硼晶胞如图,其密度为ρg/cm3,氮化硼的摩尔质量为Mg/mol,阿伏加德罗常数的值为NA,硼原子的半径为r cm,则硼原子的空间占有率为____________________(用含有ρ、M、NA、r的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种具有重要用途的气体,在工业上大量用于制造盐酸、有机溶剂和杀菌消毒剂等。甲同学在实验室进行氯气性质的研究
(1)甲同学依次进行了![]() 与①钠、②铜、③氢气、④水反应的实验。
与①钠、②铜、③氢气、④水反应的实验。
上述反应中属于氧化还原反应的是___________(填序号)。
(2)写出铁丝在氯气中燃烧的化学方程式:________。
(3)氯气溶于水得到的溶液称为氯水,新制的氯水呈_________色,新制的氯水中含有的物质为(水除外)________(填化学式)。
(4)甲同学探究氯气能否与水发生反应
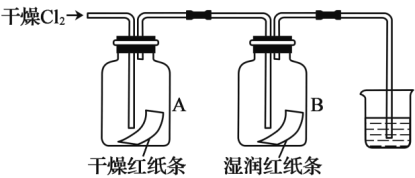
①B中纸条褪色,结合化学方程式解释原因:________。
②装置A的作用是___________。
③烧杯中发生反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊是超导材料的组成元素之一,铊在周期表中位于第6周期,与铝是同族元素,元素符号是![]() 。下列对铊及其化合物的性质的推断正确的是
。下列对铊及其化合物的性质的推断正确的是
A.![]() 的金属性强于
的金属性强于![]()
B.能生成![]() 价的化合物
价的化合物
C.铊的氢氧化物的碱性比铝弱
D.![]() 与
与![]() 都具有两性
都具有两性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com