
【题目】利用分类的方法和氧化还原反应的规律,能实现某些物质的转化。
(1)请从下列试剂中选择合适的试剂完成指定转化(试剂可以重复选择)。
试剂:Cl2、HCl、Na2S、H2O;
①I2→IO3-的离子方程式:____;
②CuSO4→Na2SO4的化学方程式:_____。
(2)利用水钴矿(主要成分是Co2O3,含少量Fe2O3、Al2O3)制取CoC2O4·2H2O的流程如下:
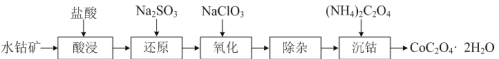
①“还原”时,Fe3+和Co3+均被还原为正二价阳离子,写出Co3+被还原的离子方程式_。
②“氧化”反应的离子方程式为:____。
【答案】I2+5Cl2+6H2O=2IO3-+10Cl-+12H+ CuSO4+Na2S=CuS↓+Na2SO4 2Co3++![]() +H2O=
+H2O=![]() +2Co2++2H+ 6Fe2++ClO
+2Co2++2H+ 6Fe2++ClO![]() +6H+=6Fe3++Cl-+3H2O
+6H+=6Fe3++Cl-+3H2O
【解析】
(1)①在氧化还原反应中,有物质化合价升高,就有化合价降低,I2中I的化合价升高,作还原剂,应选择氧化剂;
②CuSO4转化为Na2SO4,一种盐转化为另一种盐,考虑复分解反应发生的条件,生成沉淀;
(2)水钴矿加入盐酸酸浸,Fe2O3、Al2O3、Co2O3均会与HCl反应,溶液中含有Fe3+、Al3+、Co3+;加入Na2SO3,Fe3+和Co3+被还原成Fe2+、Co2+;再加入NaClO3,将Fe2+氧化成Fe3+,以便除去,最后加入(NH4)2C2O4得到产物。
(1)①在氧化还原反应中,有物质化合价升高,就有化合价降低,I2中I的化合价升高,作还原剂,应选择氧化剂,Cl2符合题意。I2中I的化合价从0价升高到+5价,生成IO3-,化合价共升高10价,Cl2中的Cl化合价从0价降低到-1价,共降低2价,化合价升降守恒,则I2和Cl2的系数比为1:5,再根据电荷守恒,物料守恒配平,离子方程式为I2+5Cl2+6H2O=2IO3-+10Cl-+12H+;
②CuSO4转化为Na2SO4,一种盐转化为另一种盐,考虑复分解反应发生的条件,生成沉淀,Na2S符合题意,化学方程式为CuSO4+Na2S=CuS↓+Na2SO4;
(2)①“还原”时,SO32-被氧化成SO42-,根据产物中Co的化合价,可知Co3+转化为Co2+,离子方程式为2Co3++SO32-+H2O=SO42-+2Co2++2H+;
②“氧化”时,Fe2+被ClO3-氧化成Fe3+,化合价升高1价;ClO3-中的Cl转化为Cl-,化合价降低6价,化合价升降守恒,则Fe2+和ClO3-的系数比为6:1,根据电荷守恒,物料守恒配平,离子方程式为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O。


科目:高中化学 来源: 题型:
【题目】将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,此装置称为甲烷燃料电池。下列叙述中正确的是( )
①通入CH4的电极为正极;
②正极的电极反应式为:O2+2H2O+4eˉ=4OHˉ;
③放电时溶液中的阳离子向正极移动;
④负极的电极反应式为:CH4+10OHˉ-8eˉ=![]() +7H2O;
+7H2O;
⑤电子迁移方向:通入CH4的铂电极→通入O2的铂电极→电解质溶液→通入CH4的铂电极
A.①③⑤B.②③④C.②④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则( )
A. 平衡向正反应方向移动了 B. 平衡向逆反应方向移动了
C. 物质B的质量分数减小了 D. a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)=2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )
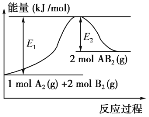
A.该反应的进行一定需要加热
B.该反应的ΔH=-(E1-E2)kJ/mol
C.该反应为吸热反应
D.断裂1molA—A键和2molB—B键放出E1kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL 0.1mol/L NaCl溶液
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:则C (NaOH) = ______________。

(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏______。
III. 我们知道空气中含有N2、O2、CO2、H2S等气体。试判断下列滴定操作的终点、分析下列现象的原因,并写出有关离子方程式。
(1)以酚酞为指示剂,用碱液滴定酸液到___________________________为终点。约半分钟后导致褪色的原因:________________________________________________。
(2)以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2=S4O62-+2I-)到 __________________为终点,约5min后溶液又显色的原因: _________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,向20 mL浓度均为0.1 mol·L1的盐酸和氯化铵混合溶液中滴加0.1 mol·L1的氢氧化钠溶液,溶液pH随氢氧化钠溶液加入体积的变化如图所示(忽略溶液体积变化)。下列说法正确的是
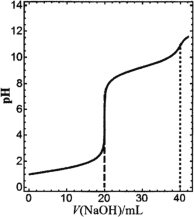
A.V(NaOH)=20 mL时,2n(![]() )+n(NH3·H2O)+n(H+)-n(OH)=0.1 mol
)+n(NH3·H2O)+n(H+)-n(OH)=0.1 mol
B.V(NaOH)=40 mL时,c(![]() )<c(OH)
)<c(OH)
C.当0<V(NaOH)<40 mL时,H2O的电离程度一直增大
D.若改用同浓度的氨水滴定原溶液,同样使溶液pH=7时所需氨水的体积比氢氧化钠溶液要小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上火法炼铜的过程中会发生以下反应:![]() ,下列关于该反应的说法正确的是( )
,下列关于该反应的说法正确的是( )
A.![]() 既是氧化产物又是还原产物B.每生成
既是氧化产物又是还原产物B.每生成![]() ,转移
,转移![]()
C.![]() 既是氧化剂又是还原剂D.每
既是氧化剂又是还原剂D.每![]() 硫原子被还原,则生成
硫原子被还原,则生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高而含有 SO2气体,实验室中利用如图所示装置验证混合气体中是否含有乙烯和 SO2 。
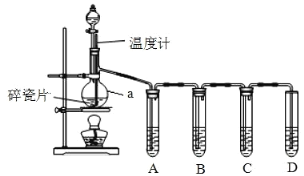
(1)仪器 a 的名称是___________,碎瓷片的作用是___________。
(2)向烧瓶中加入乙醇与浓硫酸的顺序是___________,生成乙烯的化学方程式为___________________。
(3)A、B、C、D 装置中盛放的试剂是(填序号)
A__________ , B__________ , C__________ , D___________。
供选试剂:①NaOH 溶液,②品红溶液,③酸性 KMnO4 溶液
(4)能说明 SO2 气体存在的现象是___________。
(5)证明含有乙烯的现象是___________,说明乙烯具有___________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种有机化合物的结构简式如下所示,均含有多个官能团,下列有关说法中正确的是( )
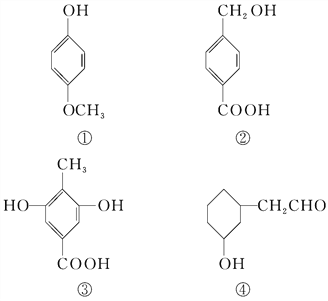
A.①属于酚类,可与NaHCO3溶液反应产生CO2
B.②属于酚类,能使FeCl3溶液显紫色
C.1 mol ③最多能与3 mol Br2发生反应
D.④属于醇类,可以发生消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com