
【题目】已知:①正丁醇沸点:117.2℃,正丁醛沸点:75.7℃;②正丁醇合成正丁醛的反应:![]() ,装置如图。下列说法不正确的是
,装置如图。下列说法不正确的是

A.为防止产物进一步氧化,应将适量Na2Cr2O7酸性溶液逐滴加入正丁醇中
B.向分馏出的馏出物中加入少量金属钠,可检验其中是否含有正丁醇
C.当温度计1示数为90~95℃,温度计2示数在76℃左右时收集产物
D.向分离所得的粗正丁醛中,加入无水CaCl2固体,过滤,蒸馏,可提纯正丁醛
【答案】B
【解析】
A.醛基具有还原性,易被氧化剂氧化成酸,Na2Cr2O7中+7价的铬具有氧化性,在酸性条件下能氧化正丁醛,实验过程中,所需正丁醇的量大于酸化的Na2Cr2O7的量,防止产物进一步氧化,正丁醇也能被酸化的Na2Cr2O7氧化,加入药品时,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中,故A正确;
B.分馏出的馏出物中的水也可以和钠反应,故不能用来检验产物中是否含有正丁醇,B不正确;
C.由反应物和产物的沸点数据可知,温度计1保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,温度计2示数在76℃左右时,收集产物为正丁醛,C正确;
D.正丁醛中有水,由于水与正丁醛的沸点相差不多,直接蒸馏,得到的正丁醛中仍还有较多的水,所以可加入无水CaCl2固体除去水,过滤后蒸馏,D正确。
答案选B。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】N2H4、N2O4常用作火箭发射的推进剂。推进剂发生反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)。下列有关说法正确的是( )
A.反应每生成0.3 mol N2,转移电子的数目为1.6×6.02×1023
B.充有N2O4的密闭容器中存在:N2O4(g)![]() 2NO2(g),当c(N2O4)∶c(NO2)=1∶2时,该可逆反应到达限度
2NO2(g),当c(N2O4)∶c(NO2)=1∶2时,该可逆反应到达限度
C.碱性N2H4—空气燃料电池工作时,正极电极反应式为O2+2H2O+4e-=4OH-
D.N2H4的水溶液中存在:N2H4+H2O![]() N2H
N2H![]() +OH-,向稀溶液中加水稀释,
+OH-,向稀溶液中加水稀释, ![]() 的值变大
的值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2 和 CH4 重整可制备合成气,催化重整反应历程示意图如下:
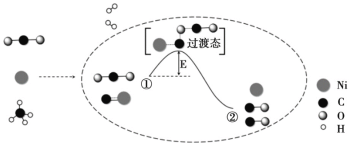
下列说法不正确的是
A.Ni 在该反应中做催化剂,参与化学反应
B.①→②吸收能量
C.①→②既有碳氧键的断裂,又有碳氧键的形成
D.合成气的主要成分为 CO 和 H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
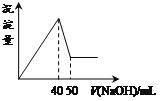
A.1:3B.1:2C.1:1D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
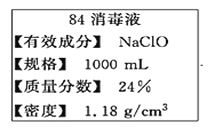
(1)NaClO中氯元素的化合价为________
(2)量取100mL此液,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=______mol/L。
(3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。用如图所示的仪器中配制溶液,还缺少的玻璃仪器是_____________。
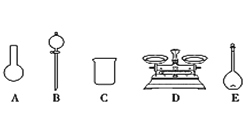
(4)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入固体再加水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(5)下面操作造成所配84消毒液浓度偏高的是___________(填序号)。
A.没有冷却到室温就转移并快速定容
B.转移时没有洗涤烧杯、玻璃棒
C.定容时俯视液面
D.称量时托盘天平“左码右物”
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2Na2CO3+SnO2+4S![]() Na2SO4+Na2SnS3+2CO2,回答下列问题:
Na2SO4+Na2SnS3+2CO2,回答下列问题:
(1)上述反应涉及的元素中,非金属性最强的元素最外层电子排布式为_____。
在上述反应的生成物中,属于分子晶体的化合物的结构式为_____。
(2)在上述反应中单质物质的原子核外共有_____种不同运动状态的电子,有_____种不同能量的电子。
(3)上述反应中,金属性最强的元素与铝元素相比较,可以作为判断两者金属性强弱依据的是_____(选填编号)。
a.能否置换出硫酸铜溶液中的铜离子
b.Al(OH)3能否溶解在该元素最高价氧化物对应的水化物中
c.单质与氯气化合时失去电子数目的多少
d.单质与同浓度的稀盐酸发生反应的剧烈程度
(4)上述反应中氧化剂与还原剂的物质的量之比是_____。
(5)常温下,测得Na2SnS3溶液pH>7,请用离子方程式解释其原因:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置测定镁带样品中单质镁的质量分数。(杂质与酸反应不产生气体)
完成下列填空:
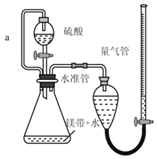
(1)硫酸必须过量的目的是_____
(2)导管a的作用是_____
(3)取两份镁带样品分别进行实验,所得数据见下表:
实验次数 | 镁带质量(g) | 氢气体积(mL)(已换算成标准状况) |
1 | 0.053 | 44.60 |
2 | 0.056 | 47.05 |
单质镁的质量分数是_____。(保留3位小数)
(4)如果测定结果偏高,可能的原因是_____。(选填编号)
a.装置漏气
b.未冷却至室温即读数
c.镁带中含有氧化镁
d.末读数时量气管的液面低于水准管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是( )
①过量的Zn与18 mol·L-1硫酸溶液反应 ②过量的氢气与少量的氮气在催化剂存在和一定条件下充分反应 ③过量的二氧化锰与浓盐酸 ④过量的铜与浓硫酸 ⑤过量的铜与稀硝酸 ⑥ 过量的稀硫酸与块状石灰石 ⑦常温下过量浓硫酸与铝
A.②③⑤B.②③④⑥⑦
C.①④⑤D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com