
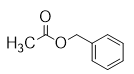
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
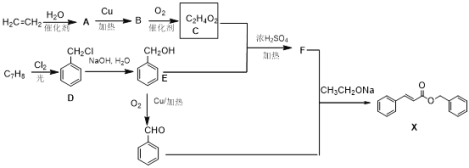
已知:RCOOH+R′OH![]() RCOOR′+H2O
RCOOR′+H2O
(1)A的化学名称______________,X中含有的官能团名称_______;
(2)X的分子式_______________,F的结构简式_______________;
(3)乙烯到A的反应类型___________,由A 生成B的化学方程式_________,C和E反应生成F的化学方程式__________;
(4)除D外,D的同分异构体芳香族化合物有(不考虑立体异构)______种,其中核磁共振有三组峰,且峰面积之比为3:2:2的结构式为______________。
【答案】乙醇 碳碳双键 酯基 C16H14O2 ![]() 加成反应 2CH3CH2OH+O2
加成反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOH+
2CH3CHO+2H2O CH3COOH+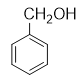
 +H2O 3
+H2O 3 ![]()
【解析】
根据合成路线图分析得:乙烯与水在催化剂作用下发生加成反应生成乙醇,故A是CH3CH2OH,乙醇催化氧化最终生成C,根据C的分子式分析C为乙酸,则中间产物B是CH3CHO;甲苯在光照条件下与氯气发生的是取代反应,生成D![]() ,D在氢氧化钠的水溶液中发生取代反应生成E
,D在氢氧化钠的水溶液中发生取代反应生成E![]() ;E能被氧化为苯甲醛
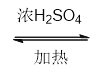
;E能被氧化为苯甲醛![]() ;C和E在浓硫酸加热的条件下发生酯化反应生成F
;C和E在浓硫酸加热的条件下发生酯化反应生成F![]() , F和苯甲醛发生脱水反应生成X
, F和苯甲醛发生脱水反应生成X![]() ,据此解答。
,据此解答。
(1) 根据上述分析,A为CH3CH2OH,化学名称是乙醇;X为![]() ,其中含有的官能团名称有碳碳双键、酯基,故答案为:乙醇;碳碳双键、酯基;
,其中含有的官能团名称有碳碳双键、酯基,故答案为:乙醇;碳碳双键、酯基;
(2) 根据上述分析X为![]() ,分子式为C16H14O2; F为乙酸与苯甲醇酯化反应所得,结构简式为
,分子式为C16H14O2; F为乙酸与苯甲醇酯化反应所得,结构简式为![]() ,故答案为:C16H14O2;
,故答案为:C16H14O2;![]() ;
;
(3) 乙烯与水发生加成反应得到A,所以反应类型为加成反应;乙醇催化氧化得到乙醛,化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;C和E酯化反应生成F的化学方程式为CH3COOH+
2CH3CHO+2H2O;C和E酯化反应生成F的化学方程式为CH3COOH+

 +H2O,故答案为:加成反应;2CH3CH2OH+O2
+H2O,故答案为:加成反应;2CH3CH2OH+O2![]() 2CH3CHO+2H2O;CH3COOH+
2CH3CHO+2H2O;CH3COOH+

 +H2O;
+H2O;
(4) 除D外,D的同分异构体芳香族化合物有氯原子苯环上的情况,与甲基的位置分别为邻、间、对3种;其中核磁共振有三组峰,且峰面积之比为3:2:2的结构式为![]() ,故答案为:3;
,故答案为:3;![]() 。
。


科目:高中化学 来源: 题型:
【题目】有关分子结构如图所示,下列叙述中,正确的是 ( )
![]()
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 所有的原子都在同一平面上
C. 12个碳原子不可能都在同一平面上
D. 12个碳原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
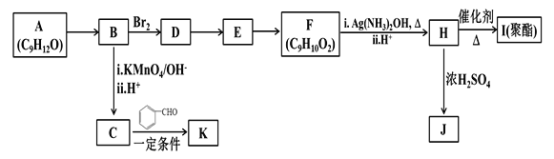
已知以下信息:
①A是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
②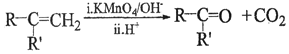
③RCOCH3+RCHO![]() RCOCH=CHR
RCOCH=CHR
回答下列问题:
(1)A生成B的反应类型为________,由D生成E的反应条件为________。
(2)H 的官能团名称为________。
(3)I的结构简式为_______。
(4)由E生成F的反应方程式为________ 。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为_______。
①能发生水解反应和银镜反应;②属于芳香族化合物且分子中只有一个甲基;
③具有5个核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。

(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
①写出能表示硫的燃烧热的热化学方程式: _____________________________
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________

②能说明上述反应达到平衡状态的是______(填编号)
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度B.缩小容器体积C.再充入CO2气体D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究其降解效果,设计如下对比实验探究温度、浓度、pH对降解速率和效果的影响,实验测得M的浓度变化与时间的关系如图所示,下列说法不正确的是( )

实验编号 | 温度(K) | pH |
① | 298 | 1 |
② | 310 | 1 |
③ | 298 | 7 |
④ | 298 | 2 |
A.实验①在15min内M的降解速率为1.33×10-5mol·L-1·min-1
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.若其他条件相同,实验①④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
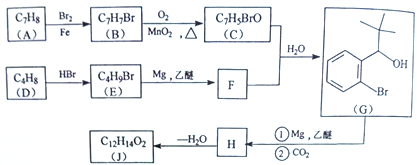
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
己知: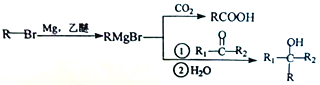
(1)G中官能团的名称为_________、_________。
(2)D的系统命名是_________。
(3)由A生成B的化学方程式为_________,反应类型_________。
(4)C与银氨溶液反应的化学方程式为________________________。
(5)H在一定条件下生成高分子化合物的结构简式为_________。
(6)写出一种同时满足下面条件的G的同分异构体的结构简式_________。
①核磁共振氢谱有4组峰②能与FeCl3溶液发生显色反应
(7)借助题中信息写出以乙醛和苯为原料,合成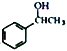 的路线流程图(其它试剂自选)。_________________________________________________________。
的路线流程图(其它试剂自选)。_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH 和 C2H518OH
B. 乙醛和丙烯醛不是同系物,它们与H2 充分反应后的产物是同系物
C. 甲苯能使酸性高锰酸钾溶液褪色,体现了侧链对苯环的影响
D. 乳酸薄荷醇酯(![]() )能发生水解反应、氧化反应、消去反应、取代反应
)能发生水解反应、氧化反应、消去反应、取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应在:2H2(g) +CO(g)![]() CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的
CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的![]() ,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com