
【题目】雷雨天闪电时空气中的臭氧(O3)生成,下列说法正确的是( )
A.O2和O3互为同位素
B.O2和O3的相互转化是物理变化
C.在相同的温度与压强下,等体积的O2和O3含有相同的分子数
D.等物质的量的O2和O3具有相同的质子数
科目:高中化学 来源: 题型:
【题目】甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)CH3OH(g).已知常温常压下反应的能量变化如图1所示: 
②
化学键 | H﹣H | H﹣O | O=O |
键能kj/mol | 436 | x | 496 |
③CO(g)+ ![]() O2(g)=CO2(g)△H=﹣280kJ/mol
O2(g)=CO2(g)△H=﹣280kJ/mol
H2(g)+ ![]() O2(g)=H2O(I)△H=﹣284kJ/mol
O2(g)=H2O(I)△H=﹣284kJ/mol
H2O(I)=H2O(g)△H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为kj/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式;
(3)H﹣O的键能x值为;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L.如反应开始时仍充入10molCO和30molH2 , 则在平衡状态B时容器的体积V(B)=L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
平衡时容器体积 | V(甲) | V(乙) | V(丙) |
反应的平衡常数K | K(甲) | K(乙) | K(丙) |
平衡时CH3OH的浓度/molL﹣1 | C(甲) | C(乙) | C(丙) |
平衡时CH3OH的反应速率/molL﹣1min﹣1 | v(甲) | v(乙) | v(丙) |
则下列说法正确的是 .
A.V(甲)>V(丙)
B.K(乙)>K(丙)
C.c(乙)>c(甲)
D.v(甲)=v(丙)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次递增,A是自然界中形成化合物种类最多的元素,且A、B两元素在元素周期表中相邻,B、C、E原子的最外层电子数之和为13,C原子最外层电子数是E原子最外层电子数的3倍,B、F原子最外层电子数之和等于C、E原子最外层电子数之和,D在同周期元素中原子半径最大。
请回答下列问题:
(1)A的元素符号为_______,其在元素周期表的位置:第______周期,第______族。
(2)元素A、B形成的最简单的气态氢化物稳定性较强的是_______ (填化学式),元素C和D可形成化合物D2C2,其电子式为_______ 。
(3)F的单质加入到D的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为________;上述反应的气体产物和C元素的单质设计成的燃料电池已用于航天飞机。试写出以30%KOH溶液为电解质溶液的这种电池在工作时负极的电极反应式为________ 。
(4)工业制取E的化学反应方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2═4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此段时间内,该反应的速率v可表示为( )
A.v(NH3)=0.010mol/(L.s)
B.v(O2)=0.010mol/(L.s)
C.v(NO)=0.0010mol/(L.s)
D.v(H2O)=0.045mol/(L.s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
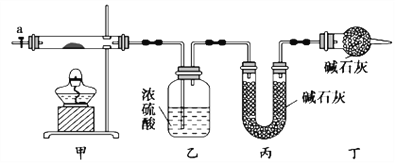
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_______________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_______(填字母)连接在__________(填装置连接位置)。
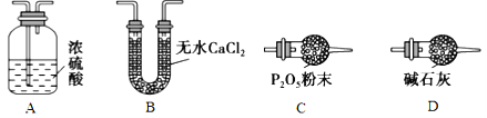
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______________。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
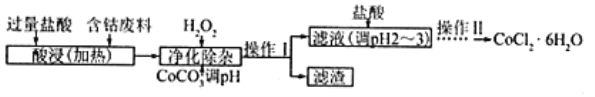
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2发生反应的离子方程式为_____________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________________。
③加盐酸调整pH为2~3的目的为_________________。
④操作Ⅱ过程为_______________(填操作名称)、过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l)△H1=﹣1301.0kJmol﹣1
O2(g)═2CO2(g)+H2O(l)△H1=﹣1301.0kJmol﹣1
②C(s)+O2(g)═CO2(g)△H2=﹣393.5kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(1)△H3=﹣285.8kJmol﹣1
O2(g)═H2O(1)△H3=﹣285.8kJmol﹣1
则反应④2C(s)+H2(g)═C2H2(g)的△H为( )
A.+228.2 kJmol﹣1
B.﹣228.2 kJmol﹣1
C.+1301.0 kJmol﹣1
D.+621.7 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,反应aX(g) ![]() bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( )
bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( )
A.a>b+c
B.a<b+c
C.a=b+c
D.a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。

请回答:
(1)密闭容器的体积是____________L;
(2)若t1=15,则0-t1s内C物质的浓度变化表示的平均反应速率v(C)=________________;
(3)写出反应的化学方程式:____________________________________________;
(4)t1时,A的转化率为_________,第7s时v(A)正_____v(B)逆(填“<”、“>”或“=”);
(5)B的起始物质的量是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com