
【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
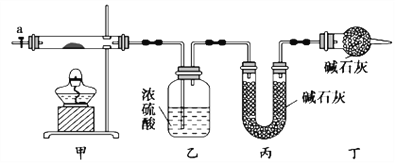
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中____________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_______________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的_______(填字母)连接在__________(填装置连接位置)。
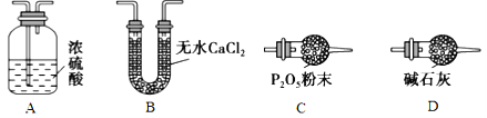
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______________。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
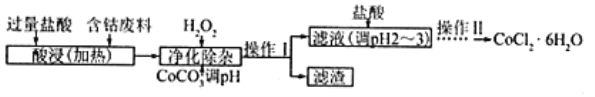
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净除杂质时,加入H2O2发生反应的离子方程式为_____________。
②加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为_____________________。
③加盐酸调整pH为2~3的目的为_________________。
④操作Ⅱ过程为_______________(填操作名称)、过滤。
【答案】 不再有气泡产生时 将装置中产生的CO2和H2O(g)全部排入乙、丙装置中 D 活塞a前(或装置甲前) Co3(OH)4(CO3)2( 2Fe2++H2O2+2H+=2Fe3++2H2O Al(OH)3、Fe(OH)3 抑制CoCl2的水解 蒸发浓缩、冷却结晶
【解析】(1)由碱式碳酸钴的化学式可知,其受热分解可生成CO2和H2O(g),则乙装置中不再有气泡产生时,说明碱式碳酸钴分解完毕,可停止加热。答案为:不再有气泡产生时
(2)为避免影响称量结果,需通入空气将装置中产生的CO2和H2O(g)全部排入乙、丙装置中。答案为:将装置中产生的CO2和H2O(g)全部排入乙、丙装置中
(3)空气中的CO2和H2O(g)可通过活塞a进入装置中,影响测量结果,则应在活塞a前添加装置D来吸收。答案为: D 、活塞a前(或装置甲前)
(4)由表中数据可知,乙装置中吸收的![]() ,丙装置中吸收的
,丙装置中吸收的![]() ,则根据氢原子和碳原子质量守恒,可得
,则根据氢原子和碳原子质量守恒,可得![]()
![]() ,可见
,可见![]() ,碱式碳酸钴的化学式为Co3(OH)4(CO3)2。答案为; Co3(OH)4(CO3)2
,碱式碳酸钴的化学式为Co3(OH)4(CO3)2。答案为; Co3(OH)4(CO3)2
(5)①含钴废料加入过量盐酸,并加热,得到的溶液中含有FeCl3和AlCl3杂质,加入H2O2可将Fe2+氧化为Fe3+,离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。②沉淀物开始沉淀的pH应小于7.6,且加入H2O2后溶液中已无Fe2+,故滤渣成分为Al(OH)3、Fe(OH)3。③Co2+会发生水解,加盐酸调节溶液的p为![]() 的目的为抑制CoCl2的水解。④操作Ⅱ为溶质结晶过程,具体步骤为蒸发浓缩、冷却结晶、过滤。答案为:①2Fe2++H2O2+2H+=2Fe3++2H2O ② Al(OH)3、Fe(OH)3 ③ 抑制CoCl2的水解 ④蒸发浓缩、冷却结晶
的目的为抑制CoCl2的水解。④操作Ⅱ为溶质结晶过程,具体步骤为蒸发浓缩、冷却结晶、过滤。答案为:①2Fe2++H2O2+2H+=2Fe3++2H2O ② Al(OH)3、Fe(OH)3 ③ 抑制CoCl2的水解 ④蒸发浓缩、冷却结晶


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是
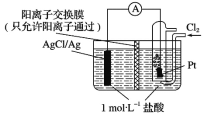
A. 正极反应为AgCl+e-===Ag+Cl-
B. 负极反应为Ag-e-===Ag+
C. 放电时,交换膜右侧溶液中有大量白色沉淀生成
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,化学平衡常数表达式为: ![]() ,恒容时,温度升高H2浓度减小.下列说法正确的是( )
,恒容时,温度升高H2浓度减小.下列说法正确的是( )
A.该反应化学方程式为:CO(g)+H2O(g)CO2(g)+H2(g)
B.恒温恒容下,反应达平衡时,再通入一定量的CO2气体,CO的体积分数一定增大
C.升高温度,正反应速率增大,逆反应速率减小
D.该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2=CH2(g) +4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如右下图。下列说法正确的是
CH2=CH2(g) +4H2O(g)。已知温度对CO2的平衡转化率和催化剂催化效率的影响如右下图。下列说法正确的是
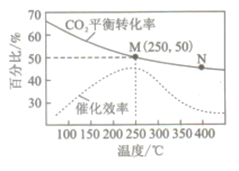
A. M点的正反应速率v正大于N点的逆反应速率v逆
B. 若投料比n(H2) :n(CO2) =4:1,则图中M点己烯的体积分数为5.88%
C. 250℃,催化剂对CO2平衡转化率的影响最大
D. 当温度高于250℃,升高温度,平衡逆向移动导致催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中的臭氧(O3)生成,下列说法正确的是( )
A.O2和O3互为同位素
B.O2和O3的相互转化是物理变化
C.在相同的温度与压强下,等体积的O2和O3含有相同的分子数
D.等物质的量的O2和O3具有相同的质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. ClO2具有氧化性,可用于水的消毒杀菌
B. SO2具有还原性,可用于纸浆的漂白
C. MnO2具有氧化性,可用于H2O2制O2
D. SiO2能与强碱反应,可用于制光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于实验室药品的保存与取用:
(1)液体药品应放在___(填“细口”或“广口”,下同)瓶中,而固体药品应放在___瓶中。
(2)取用块状固体时用___,取用粉末状固体时用___。对于见光易分解的药品应放在___色的瓶中保存,同时不得___任何药品的味道。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,生成物中物质的量最大的是( )
A.CH3Cl
B.CH2Cl2
C.CCl4
D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用pH=m的盐酸滴定20mLpH=n的MOH溶液,且m+n=14。混合溶液的pH与盐酸体积 (V)的关系如图所示。下列说法正确的是

A. Kb(MOH)的数量级为10-11 B. 由c点可算得m=![]()
C. a点:c(Cl-)>c(M+)>c(OH-)>(H+) D. b点溶液呈中性,此时c(Cl-)=c(M+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com