
【题目】下列关于电化学的理解正确的是( )
A.原电池一定是负极材料失电子,发生氧化反应
B.电解池的电极材料一定不参与电极反应
C.原电池的负极和电解池的阳极一定发生氧化反应
D.原电池中的阳离子移向负极,电解池中的阳离子则移向阴极
科目:高中化学 来源: 题型:
【题目】下列开发利用自然资源制取化学品,其简示途径较为合理的是( )
A.海水 ![]()
![]() Br2
Br2
B.海产品(如海带等) ![]()
![]() 滤液
滤液 ![]()
![]()
![]() I2
I2
C.海水 ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO ![]() Mg
Mg
D.铝土矿 ![]() 滤液
滤液 ![]() Al(OH)3
Al(OH)3 ![]()
![]() Al
Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学分别用如图所示三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气.请你参与探究,并回答下列问题:
(1)三位同学制取气的化学方程式为:
(2)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨气(如果他们的实验操作
都正确),你认为没有收集到氨气的同学是(填“”、“乙”或“丙”),收集不到氨气的主要原因是 .
(3)检验氨气是否收集满的方法是
(4)三位同学都认他们的实验装置也可用于加热碳酸氢铵固体制取纯净的氨气,你判断
能够达到实验目的是(填“甲”、“乙”或“丙”).该装置中的NH4HCO3固体能否用NH4Cl固体代替?(填“能”或“不能”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:
![]()
试回答下列问题:
(1)“酸溶”过程中Fe3O4发生反应的离子方程式为_________________;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有__________、玻璃棒和烧杯等;步骤Ⅳ中最好应选用_______试剂调节溶液的pH(填字母编号)。
A.稀硝酸 B.氧化铜 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是_____________________;
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是______________________;
(5)步骤Ⅵ中发生反应的化学反应方程式为_______________________________;
(6) 欲测定硫铁矿矿渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg,测得该样品中Fe元素的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为50mL的A,B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.在稀释后的溶液中逐滴加入0.1mol.L﹣1的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示.下列说法正确的是( )
A.在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是①NaOH、Na2CO3 ②Na2CO3③Na2CO3、NaHCO3 ④NaHCO3
B.B曲线说明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是11.2L(标准状况)
C.原NaOH溶液的物质的量浓度为0.100mol/L
D.B曲线表明,原溶液通入CO2后,所得溶液中溶质的化学式为NaOH、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: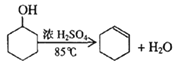


(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入块状物质,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①块状物质的作用是___________,导管B的作用是___________。
②试管C置于冰水浴中的目的是____________________________________。

(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_______口流出,目的是_________
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___________
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______________________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 碱金属元素最外层电子数都是1个,化学性质均活泼
B. 碱金属元素从上到下随电子层数的增多金属性依次增强
C. 碱金属元素的单质都是银白色的,都比较柔软
D. 碱金属元素的单质从上到下熔沸点逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应体系的物质有:NaOH,Au2O3 , Na2S4O6 , Na2S2O3 , Au2O,H2O.下列选项正确的是( ) ![]()
A.Na2S4O6 , H2O,Na2S2O3 , Au2O,NaOH
B.Na2S2O3 , H2O,Na2S4O6 , Au2O,NaOH
C.Na2S2O3 , NaOH,Na2S4O6 , Au2O,H2O
D.当1mol Au2O3完全反应时,转移电子的物质的量为8mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com