
����Ŀ��ij��ѧС���������������������װ�ã���ͼ�����Ի������Ʊ�����ϩ
��֪��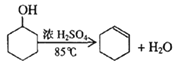


��1���Ʊ���Ʒ
��12.5mL�����������Թ�A�У��ټ���1mLŨ���ᣬҡ�Ⱥ�����״���ʣ�������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
�ٿ�״���ʵ�������___________������B��������___________��
���Թ�C���ڱ�ˮԡ�е�Ŀ����____________________________________��

��2���Ʊ���Ʒ
�ٻ���ϩ��Ʒ�к��л������������������ʵȡ����뱥��ʳ��ˮ�������á��ֲ㣬����ϩ��_________��(���ϻ���)����Һ����_________ (������)ϴ�ӡ�
a��KMnO4��Һ b��ϡH2SO4 c��Na2CO3��Һ
���ٽ�����ϩ����ͼװ��������ȴˮ��_______��������Ŀ����_________
���ռ���Ʒʱ�����Ƶ��¶�Ӧ��_________���ң�ʵ���ƵõĻ���ϩ��Ʒ�����������۲��������ܵ�ԭ����___________
a������ʱ��70����ʼ�ռ���Ʒ
b��������ʵ����������
c���Ʊ���Ʒʱ���������Ʒһ������
��3���������ֻ���ϩ��Ʒ�ʹ�Ʒ�ķ�������������_______________________��
a�������Ը��������Һ b���ý����� c���ⶨ�е�
���𰸡� ������ �������������� ��ֹ����ϩ�ӷ� �ϲ� C f ��ȴˮ�������γ����� 83 �� c bc
��������������������⿼�黷��ϩ���Ʊ�������ϩ��Ʒ���ᴿ��
��1������ʵ������ȡ����������ʵ��������״����Ϊ��ʯ�����Ƭ���������Ƿ����С�����B�������ǵ������������塣
������ϩ�ķе�ϵ�������ϩ�ӷ����Թ�C���ڱ�ˮԡ�е�Ŀ��������һ����ȴ����ֹ����ϩ�ӷ���
��2��������ϩ���ܶȱ�ˮС��������ˮ�����뱥��ʳ��ˮ�������á��ֲ㣬����ϩ���ϲ���a�KMnO4��Һ�ܽ�����ϩ����������b�ϡ����ܳ�ȥ�������ʣ�����c�����Na2CO3�����ջ������������������ʣ���ȷ����ѡc��
������ʱ��ȴˮӦ���¿ڽ������Ͽ���������g�ڽ��롢f����������ȴˮ�½��ϳ���Ŀ��������ȴˮ�������γ�������ʹ�������������
������ϩ�ķе�Ϊ83�棬�ռ���Ʒʱ���¶ȿ�����83��������a�����ʱ��70�濪ʼ�ռ���Ʒ����ǰ�ռ�����Ʒ�л������ʣ�ʵ�ʲ����������۲�����b����������ʵ���������ˣ����ɵĻ���ϩ���ʵ�������ʵ�ʲ����������۲�����c�����Ʊ���Ʒʱ���������Ʒһ�����������ɵĻ���ϩ���ʵ�����С��ʵ�ʲ����������۲�������ѡc��
��3��a��������ϩ��Ʒ�ʹ�Ʒ����ʹ���Ը��������Һ��ɫ���������֣�b��������ϩ��Ʒ��Na����Ӧ����Ʒ�еĻ�����������������Na��Ӧ����H2�������֣�c��������ϩ��ƷΪ�������й̶��е�83������ƷΪ������̶��е㣬�����֣���ѡbc��


 �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԭ������������������ֶ�����Ԫ�أ�����XԪ��ԭ�ӵĺ������������������Ӳ����� X��Y��W�ɷֱ��γ�YX3��XW���ۻ����YX3��������ˮ, ZԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�W ��ԭ�Ӱ뾶�ǵ�����������С�ġ�
��1��д��YX4+�ĵ���ʽ_______��
��2��д��Z��W���γɵ����� YX3��ˮ��Һ��Ӧ�����ӷ���ʽ________________��
��3�������£�pH��3��XW��Һ��pH��5��YX4W��Һ����ˮ�������c(H+)�ı�Ϊ___��
��4����֪X���ʺ�Y���ʷ�Ӧ����YX3�ķ�Ӧ�ǿ��淴Ӧ����H<0, ��X��Y�����ֵ����Ե����ʵ�������һ�ܱ������У����ʵ������ͺ��¡���ѹ�����·�Ӧ������˵����ȷ����_____________________��
a���ﵽ��ѧƽ��ʱ���κ�һ�����ʱ�ʾ������Ӧ�������淴Ӧ�������
b����Ӧ�����У�Y���ʵ��������ʼ��Ϊ50%
c���ﵽ��ѧƽ��ʱ��X��Y���ֵ����ڻ�������е����ʵ���֮��Ϊ1��1
d���ﵽ��ѧƽ��Ĺ����л�������ƽ����Է���������С
��5����������Ѱ����ʵĴ����͵缫���ϣ���Y2��X2Ϊ�缫��Ӧ���XW��YX4W Ϊ�������Һ�Ʊ�����ȼ�ϵ�ء���д���õ�ص�������Ӧʽ_____________��
��6������β���к���CO��NO��NO2���ж����壬��������װβ������װ�ã��ú����ȹ���Ԫ�صĴ���������ʹ�ж��������Ӧת���������塣
��֪��N2(g)��2O2(g)��2NO2(g) ��H1����68 kJ��mol-1
2C(s)��O2(g)��2CO(g) ��H2����221 kJ��mol-1
C(s)��O2(g)��CO2 (g) ��H3����393.5 kJ��mol-1
CO��NO2��Ӧ���Ȼ�ѧ����ʽΪ____________________����Ӧһ�������¿��棬�¶Ȳ�ͬ��T2��T1���߾����ڳ��£�������������ͬ������ͼ����ȷ����______��
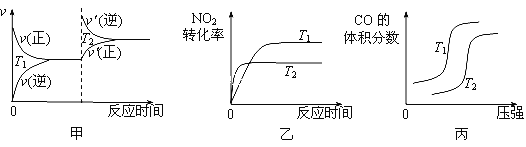
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾˮ������ӷ���ʽ��ȷ���ǣ� ��
A.CH3COO��+H2OCH3COOH+OH��
B.NH4++H2ONH4OH+H+
C.S2��+2H2OH2S+2OH��
D.HCO3��+H2OH3O++CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ绯ѧ��������ȷ���ǣ� ��
A.ԭ���һ���Ǹ�������ʧ���ӣ�����������Ӧ
B.���صĵ缫����һ��������缫��Ӧ
C.ԭ��صĸ����͵��ص�����һ������������Ӧ
D.ԭ����е������������������е�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ��ص��ܷ�ӦΪ��Cu+2Fe3+�TCu2++2Fe2+�� ��
A | B | C | D | |
�缫���� | Cu��Zn | Cu��Ag | Fe��Zn | Cu��C |
������Һ | FeCl3 | Fe��NO3�� 2 | CuSO4 | Fe2��SO4��3 |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����;�ˮ���������ƣ�Na2FeO4����ͨ�����·�Ӧ�Ʊ���Fe2O3+3Na2O2 ![]() 2Na2FeO4+Na2O������˵����ȷ���ǣ� ��
2Na2FeO4+Na2O������˵����ȷ���ǣ� ��
A.Na2O2�������������ǻ�ԭ��
B.Na2FeO4���������������ǻ�ԭ����
C.��Na2FeO4��FeΪ+4�ۣ�����ǿ�����ԣ���ɱ������
D.3 mol Na2O2������Ӧ����12 mol����ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D���ֻ��������A��C��D��ɫ��Ӧ��Ϊ��ɫ����B����ɫ��ӦΪ��ɫ��A��C�����ᷴӦ���õ�D��������C���ȿɵõ�A������A����Һ��ͨ��һ����ɫ��ζ���壬�ֿ��Ƶ�C����B����Һ�μӵ�����������Һ�У�����Ϊ���ְ�ɫ����������ɫ���������ɫ����E�����ƶϣ�
��1��B����E��
��2����C���ȷֽ�Ļ�ѧ����ʽ�� ��A����ɫ��ζ���巴Ӧ�����ӷ���ʽ��
���ɰ�ɫ�������ձ�Ϊ���ɫ����E�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ְ�ɫ��ĩ����ˮ̼���ƺ�̼�����ƵĻ�����ȡ4.42g���������أ��ѷų�������ͨ����������ʯ��ˮ�У�����2.00g���������պ�IJ�������30mL����ǡ����ȫ��Ӧ������
��1���ð�ɫ��ĩ���պ���������ڱ�״���µ������
��2��ԭ������и����ʵ�������
��3��������������ʵ���Ũ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W����A��B����Ԫ����ɵ�AB2�ͻ����
��1����W�ͽ�̿�ڸ����·�����Ӧ�����Ƶõİ뵼�����Ӧ�ù㷺����WΪ________(�ѧʽ)��
��2����ȡ��֧�Թֱܷ��������W��Һ����һ֧�Թ��е���KSCN��Һ����������������һ֧�Թ��м���������ˮ���ټ�������CCl4�������ã��²���Һ���Ϻ�ɫ�����ϲ���Һ�е���KSCN��Һ����Һ�ʺ�ɫ��
��W��Һ����������������Ϊ________��
������ʵ���У�W��������ˮ��Ӧ�����ӷ���ʽΪ_____________________��
��3����W�����ӻ���������������Ӿ���18�����ӣ������������Ӹ�����Ϊ1��1��
�������ӵĵ���ʽΪ________��
��1 mol W������ˮ��ַ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ________mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com