
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数, X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水, Z元素是地壳中含量最高的金属元素,W 的原子半径是第三周期中最小的。
(1)写出YX4+的电子式_______。
(2)写出Z与W所形成的盐与 YX3的水溶液反应的离子方程式________________。
(3)室温下,pH=3的XW溶液与pH=5的YX4W溶液中由水电离出的c(H+)的比为___。
(4)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0, 将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的是_____________________。
a.达到化学平衡时,任何一种物质表示的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中混合气体的平均相对分子质量减小
(5)有人设想寻求合适的催化剂和电极材料,以Y2、X2为电极反应物,以XW-YX4W 为电解质溶液制备新型燃料电池。请写出该电池的正极反应式_____________。
(6)汽车尾气中含有CO、NO、NO2等有毒气体,对汽车加装尾气净化装置,用含铂等过渡元素的催化剂催化,可使有毒气体相互反应转化成无毒气体。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+68 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221 kJ·mol-1
C(s)+O2(g)=CO2 (g) ΔH3=-393.5 kJ·mol-1
CO与NO2反应的热化学方程式为____________________,反应一定条件下可逆,温度不同(T2>T1二者均大于常温)、其他条件相同,下列图像正确的是______。
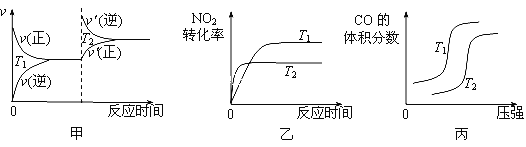
【答案】 略 Al3+ +3NH3·H2O =Al(OH)3↓+3NH4 + 1:106 ab N2+6e-+8H+=2NH4+ 4CO(g)+ 2NO2(g)=4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 乙
【解析】本题考查元素周期表和元素周期律的应用,以及化学反应原理的应用,X元素原子的核外电子总数等于其电子层数,即X为H,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水,推出YX3为NH3,即Y为N,W位于VIIA,Z元素是地壳中含量最高的金属元素,即Z为Al,W为Cl,(1)YX4+为NH4+,其电子式为:![]() ;(2)Z与W形成的盐为AlCl3,YX3为NH3,因此反应的离子方程式为: Al3++3NH3·H2O=Al(OH)3↓+3NH4+;(3)pH=3的盐酸溶液中:水电离出的c(H+)等于水电离出的c(OH-),水电离出的c(H+)=c(OH-)=Kw/c(H+)=10-14/10-3mol·L-1=10-11mol·L-1,pH=5的NH4Cl溶液中,H+完全是由水电离产生,因此水电离出c(H+)=10-5mol·L-1,因此两者的比值为10-11:10-5=1:106;(4)发生的反应是N2+3H2
;(2)Z与W形成的盐为AlCl3,YX3为NH3,因此反应的离子方程式为: Al3++3NH3·H2O=Al(OH)3↓+3NH4+;(3)pH=3的盐酸溶液中:水电离出的c(H+)等于水电离出的c(OH-),水电离出的c(H+)=c(OH-)=Kw/c(H+)=10-14/10-3mol·L-1=10-11mol·L-1,pH=5的NH4Cl溶液中,H+完全是由水电离产生,因此水电离出c(H+)=10-5mol·L-1,因此两者的比值为10-11:10-5=1:106;(4)发生的反应是N2+3H2 ![]() 2NH3,a、根据化学平衡状态的定义,一定条件下,当正反应速率等于逆反应速率,说明反应达到平衡状态,故a正确;
2NH3,a、根据化学平衡状态的定义,一定条件下,当正反应速率等于逆反应速率,说明反应达到平衡状态,故a正确;
b、N2+3H2 ![]() 2NH3
2NH3
起始: 1 1 0
变化: x 3x 2x
任意时刻:1-x 1-3x 2x
N2的体积分数等于其物质的量分数,即为![]() ,故b正确;c、根据b选项分析,达到平衡时,两者气体物质的量比值为(1-3x):(1-x),故c错误;d、根据M=m/n,组分都是气体,因此气体质量不变,反应向正反应方向进行,气体物质的量减小,即M增大,故d错误;(5)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,根据原电池的工作原理,电池正极上得到电子,化合价降低,发生还原反应,因此N2在正极上反应,即电极反应式为:N2+6e-+8H+=2NH4+;(6)根据盖斯定律,①N2(g)+2O2(g)=2NO2(g) ,②2C(s)+O2(g)=2CO(g) ,③C(s)+O2(g)=CO2 (g),CO和NO2发生的反应是4CO+2NO2=N2+4CO2,③×4-②×2-①得出△H=(-393.5×4+221×2-68)kJ·mol-1=-1200kJ·mol-1,热化学反应方程式为: 4CO(g)+ 2NO2(g)=4CO2(g)+N2(g) ΔH=-1200kJ·mol-1;甲图像:因为T2>T1,升高温度,正逆反应速率都增大,故甲图错误;乙图像:温度升高,化学反应速率加快,首先达到平衡,此反应属于放热反应,升高温度,平衡向逆反应方向移动,NO2的转化率降低,故乙图像正确;丙图像:加压,平衡向体积减小方向移动,即增大压强,平衡向正反应方向移动,CO体积分数随着压强的增大而减小,故丙图像错误。
,故b正确;c、根据b选项分析,达到平衡时,两者气体物质的量比值为(1-3x):(1-x),故c错误;d、根据M=m/n,组分都是气体,因此气体质量不变,反应向正反应方向进行,气体物质的量减小,即M增大,故d错误;(5)以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,根据原电池的工作原理,电池正极上得到电子,化合价降低,发生还原反应,因此N2在正极上反应,即电极反应式为:N2+6e-+8H+=2NH4+;(6)根据盖斯定律,①N2(g)+2O2(g)=2NO2(g) ,②2C(s)+O2(g)=2CO(g) ,③C(s)+O2(g)=CO2 (g),CO和NO2发生的反应是4CO+2NO2=N2+4CO2,③×4-②×2-①得出△H=(-393.5×4+221×2-68)kJ·mol-1=-1200kJ·mol-1,热化学反应方程式为: 4CO(g)+ 2NO2(g)=4CO2(g)+N2(g) ΔH=-1200kJ·mol-1;甲图像:因为T2>T1,升高温度,正逆反应速率都增大,故甲图错误;乙图像:温度升高,化学反应速率加快,首先达到平衡,此反应属于放热反应,升高温度,平衡向逆反应方向移动,NO2的转化率降低,故乙图像正确;丙图像:加压,平衡向体积减小方向移动,即增大压强,平衡向正反应方向移动,CO体积分数随着压强的增大而减小,故丙图像错误。


科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) ![]() 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
CH4(g) + 4NO(g) ![]() 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=____。
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g)![]() 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____(填字母)。
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA___KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些___________。

a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是____(填字母)。

a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,用蒸馏水稀释1 mol·L-1氨水至0.01 mol·L-1,随溶液的稀释,下列各项中始终保持增大趋势的是( )
A. 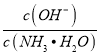 B.
B. 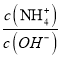 C.
C. 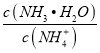 D. c(OH-)
D. c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列开发利用自然资源制取化学品,其简示途径较为合理的是( )
A.海水 ![]()
![]() Br2
Br2
B.海产品(如海带等) ![]()
![]() 滤液
滤液 ![]()
![]()
![]() I2
I2
C.海水 ![]() Mg(OH)2
Mg(OH)2 ![]() MgO
MgO ![]() Mg
Mg
D.铝土矿 ![]() 滤液
滤液 ![]() Al(OH)3
Al(OH)3 ![]()
![]() Al
Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
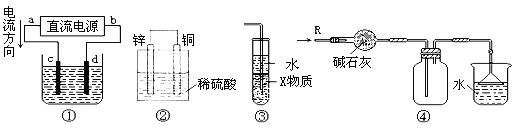
A. 若采用装置①铝件镀银,则c极为铝件,d极为纯银,电解质溶液为AgNO3溶液
B. 装置②是原电池,能将化学能转化为电能,SO42-移向锌电极
C. 装置③中X若为四氯化碳,用于吸收氨气或氯化氢,会引起倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鉴别二甲醚和乙醇可采用化学方法或物理方法,下列方法不能对二者进行鉴别的是( )
A.利用金属钠或金属钾法
B.利用红外光谱法
C.利用质谱法
D.利用核磁共振氢谱法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b代表2种金属,下列叙述中,肯定能判断金属活动性a比b强的是( )
A. 常温下,a能从水中置换出氢,而b不能 B. 原子的电子层数a比b多
C. 原子的最外层电子数a比b少 D. 1 mol a 、b分别与足量盐酸反应,生成H2的质量a比b大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: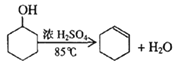


(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入块状物质,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①块状物质的作用是___________,导管B的作用是___________。
②试管C置于冰水浴中的目的是____________________________________。

(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_______口流出,目的是_________
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是___________
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_______________________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com