
【题目】图a是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图。根据图意回答下列问题:
a 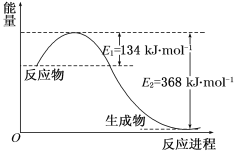 b
b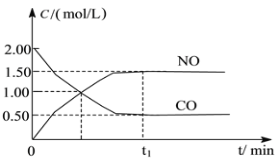
(1)写出NO2和CO反应的热化学方程式_______________。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=__________。
(3)此温度下该反应的平衡常数K=_________;温度降低,K________(填“变大”、“变小”或“不变”)
【答案】NO2(g)+CO(g)=NO(g)+CO2(g) ΔH= —234 kJ/mol 1.50/t1 mol·L-1·min-1 9 变大
【解析】
(1)根据能量变化图,反应热等于生成物的总能量减去反应物的总能量,反应物和生成物能量的差值为E2-E1,写出化学方程式,标出各物质的状态,从而写出热化学方程式;
(2)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,根据v=![]() 计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);
计算v(NO),再利用速率之比等于化学计量数之比计算v(NO2);
(3)开始加入的CO和NO的物质的量相等,根据CO的起始浓度2mol/L确定NO2的起始浓度也为2mol/L,达到平衡时CO的浓度为0.5mol/L,故NO2的浓度也为0.5mol/L,根据方程式计算出NO和CO2的浓度均为1.5mol/L,代入平衡常数表达式计算出化学平衡常数;该反应为放热反应,降低温度,平衡向右移动,化学平衡常数增大。
(1)该反应的焓变△H=E1-E2=134kJ/mol-368kJ/mol=-23kJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJmol-1,故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJmol-1。
(2)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,故v(NO)=1.5mol/L÷t1min=1.5/t1molL-1min-1,速率之比等于化学计量数之比,故v(NO2)=v(NO)=1.5/t1molL-1min-1,故答案为:1.5/t1molL-1min-1。
(3)CO的起始浓度为2mol/L,二氧化氮与NO的起始物质的量相等,故NO2的起始浓度为2mol/L,平衡时NO的浓度变化量为1.5mol/L,则:
NO2(g)+CO(g)=CO2(g)+NO(g)
开始(mol/L):2 2 0 0
变化(mol/L):1.5 1.5 1.5 1.5
平衡(mol/L):0.5 0.5 1.5 1.5
故该温度下平衡常数K=1.5×1.5/0.5×0.5=9,该反应正反应是放热反应,降低温度平衡向正反应方向移动,平衡常数变大,故答案为:9:变大。


科目:高中化学 来源: 题型:
【题目】下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是()
编号 | 化学反应 | 离子方程式 | 评价 |
| 碳酸钙与醋酸反应 |
| 错误,碳酸钙是弱电解质,不应写成离子形式 |
| 向 |
| 错误,碱过量,应生成 |
|
|
| 正确 |
| 等物质的量的 |
| 正确 |
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A. 含有NA个氧原子的氧气在标准状况下的体积约为22.4 L
B. 2 L 0.3 mol·L-1的硫酸钾溶液中钾离子浓度为0.6 mol·L-1
C. 常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D. 25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镍可用于制作发光器件、半导体激光器、太阳能电池和高速集成电路。
(1)基态Ni原子的价电子排布式为 ___,基态As原子电子占据最高能级的电子云轮廓图为 __ 形。
(2)第一电离能As ___Se(填“>”或“<”) ,原因是____。As2O3(砒霜)是两性氧化物,As2O3溶于盐酸生成AsCl3,AsCl3用LiAlH4还原生成AsH3。
(3)①AlH4-的中心原子的杂化方式为___,其空间构型为____,写出一种与AlH4-互为等电子体的分子的化学式___。
②AsH3分子中H—As—H键角__109.5°(填“>”、“=”或“<”)。AsH3沸点低于NH3,其原因是____。
(4)有机砷![]() 是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
是治疗昏睡病不可缺少的药物,该有机砷中存在的化学键的种类为____(填字母编号)。
a.离子键 b.σ键 c.π键 d.碳碳双键
(5)砷化镍激光在医学上用于治疗皮肤及粘膜创面的感染、溃疡等,砷化镍晶胞如图所示,该晶胞密度ρ为____g·cm-3(列式即可,不必化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数如下表所示:
化学式 | CH3COOH | H2CO3 | HClO | |
平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a. CH3COOH b. H2CO3 c. NaHCO3 d. HClO
pH由小到大的排列顺序是____(填字母)。
(2)常温下,0.1 mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____(填字母)。
A. c(H+) B.![]() C. c(H+)·c(OH-) D.
C. c(H+)·c(OH-) D.![]() E.
E.![]()
(3)体积均为100 mL、pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是____。在上述体积、pH均相同的CH3COOH与一元酸HX中加入足量的锌,生成的氢气在相同情况的体积大小关系为:CH3COOH____(填“大于”、“小于”或“等于”)HX

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A. w=36.5c/1000ρ B. c=1000ρw/36.5
C. c=Vρ/(36.5V+22400) D. w=36.5V/(36.5V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水FeCl3呈棕红色,极易潮解,100 ℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
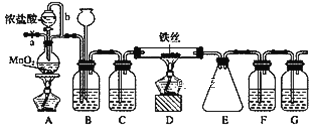
(1)装置A中反应的离子方程式为________________。
(2)装置C中所加的试剂为____________。
(3)导管b的作用为___________;装置G的作用为________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,是因为_____。
(5)为检验所得产品为FeCl3,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入____________,___________(填试剂和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,35.5g氯气的体积是___L,将其与氢气完全化合生成氯化氢的物质的量是___mol,将生成的气体制成1L溶液,溶质的物质的量浓度是___mol/L,将此溶液取出20mL加蒸馏水稀释成200mL溶液,此稀稀后的溶液中溶质的物质的量浓度是___mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com