
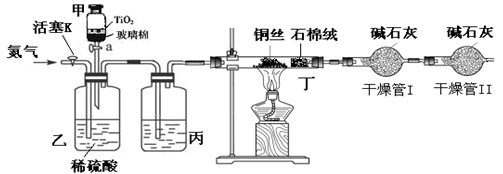
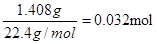 ,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。
,所以CNO—的物质的量是0.032mol。CN-的总的物质的量是0.04mol,所以根据原子守恒可知,该实验中测得CN-被处理的百分率为80%。

科目:高中化学 来源:不详 题型:实验题
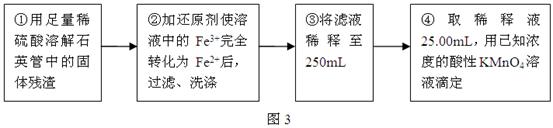
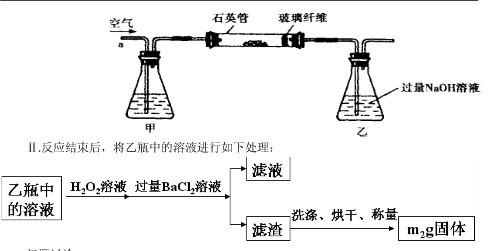
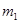 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2 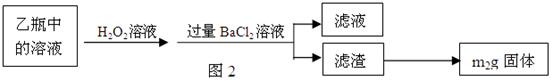
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯乙烷与NaOH溶液共热,在水解后的溶液中加入硫酸,再加入AgNO3溶液检验Cl-[ |
| B.将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 |
| C.实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 |
| D.向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④⑤ | B.②③⑤ | C.②③④⑤ | D.全部都可以 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
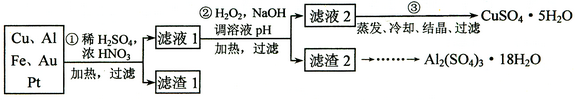
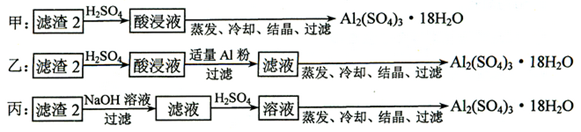
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
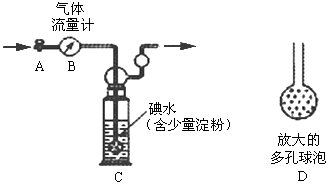
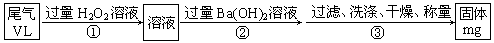
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
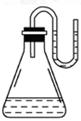
| A.NaOH固体 | B.浓H2SO4 | C.NH4NO3晶体 | D.Na2O2固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.在催化剂存在的条件下,苯和溴水发生反应可生成无色、比水重的液体溴苯。 |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验。 |
| C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇。 |
| D.有朝一日宇航员乘坐“嫦娥”遨游月空时,在其轨道舱中无法完成“粗盐的提纯”实验 |
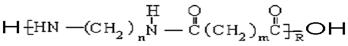 的单体为___________
的单体为___________ 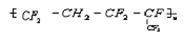 合成它的单体为________________________
合成它的单体为________________________查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
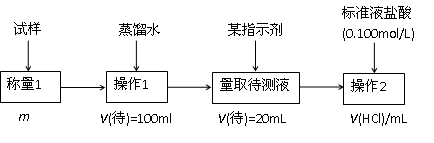

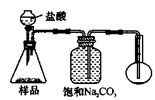
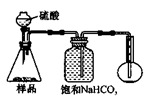
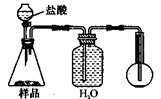
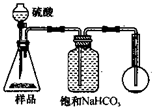
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com