
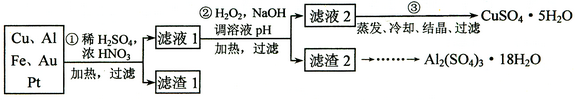
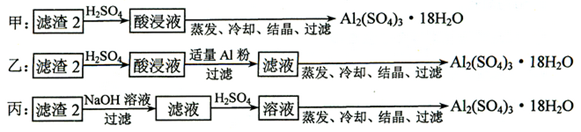
 Cu2++2NO2↑+2H2O;3Cu+2NO3-+8H+
Cu2++2NO2↑+2H2O;3Cu+2NO3-+8H+  3Cu2++2NO↑+4H2O;Au、Pt;
3Cu2++2NO↑+4H2O;Au、Pt; ;c。
;c。 Cu2++2NO2↑+2H2O,最后发生:3Cu+2NO3-+8H+
Cu2++2NO2↑+2H2O,最后发生:3Cu+2NO3-+8H+  3Cu2++2NO↑+4H2O;金属混合物中只有Au和Pt不溶于硝酸,其是滤渣的主要成分;
3Cu2++2NO↑+4H2O;金属混合物中只有Au和Pt不溶于硝酸,其是滤渣的主要成分;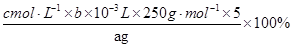 ;滴定过程中,未干燥锥形瓶,对结果无影响,排除a;滴定终点时滴定管尖嘴中产生气泡,造成消耗EDTA的读数偏小,测定结果偏低,排除b;未除净干扰离子,造成EDTA消耗偏多,测定结果偏高,选c。
;滴定过程中,未干燥锥形瓶,对结果无影响,排除a;滴定终点时滴定管尖嘴中产生气泡,造成消耗EDTA的读数偏小,测定结果偏低,排除b;未除净干扰离子,造成EDTA消耗偏多,测定结果偏高,选c。

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:实验题

| 滴定次数 | 待测体积(ml) | 标准烧碱体积(ml) | |
| 滴定前读数 | 滴定后读数 | ||
| 第1次 | 20.00 | 0.40 | 20.40 |
| 第2次 | 20.00 | 4.00 | 24.00 |
| 第3次 | 20.00 | 0.10 | 22.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。
2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。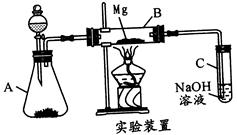
| 实验操作 | 预期现象 | 结论 |
| (1)取少许反应后试管C中的溶液加入足量的BaCl2溶液 | 无白色沉淀产生 | 证明假设_______是正确的 |
| (2)若有白色沉淀产生再检测(1)的上层溶液的PH | 若PH>7 | 证明__________正确 |
| 若PH=7 若PH<7 | 证明__________正确 证明__________正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
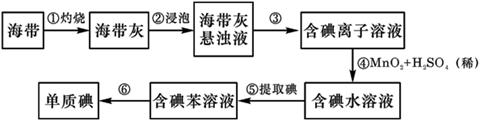
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2CrO42-+2H+左移,导致滴定终点滞后。
2CrO42-+2H+左移,导致滴定终点滞后。| 实验序号 | FeSO4溶液的体积读数/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 16.20 |
| 2 | 0.30 | 15.31 |
| 3 | 0.20 | 15.19 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
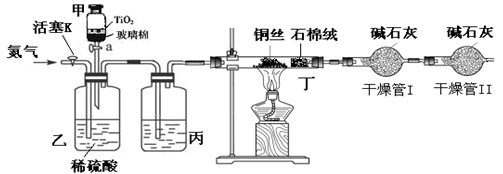
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
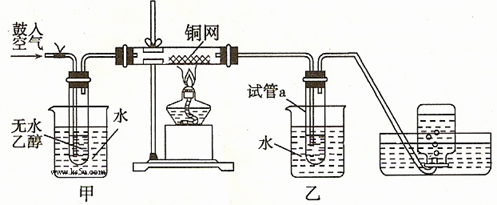
 。(填写化学式或分子式)
。(填写化学式或分子式) 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
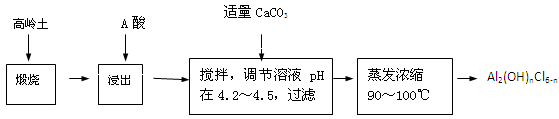
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸式滴定管在装液前未用标准酸溶液润洗2~3次 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.滴定前平视读数,滴定后俯视读数 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com