
 2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。
2MgO+C的启发,用如图所示的装置进行Mg和SO2的实验。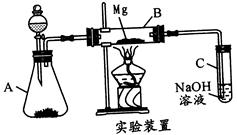
| 实验操作 | 预期现象 | 结论 |
| (1)取少许反应后试管C中的溶液加入足量的BaCl2溶液 | 无白色沉淀产生 | 证明假设_______是正确的 |
| (2)若有白色沉淀产生再检测(1)的上层溶液的PH | 若PH>7 | 证明__________正确 |
| 若PH=7 若PH<7 | 证明__________正确 证明__________正确 |
 2MgO+MgS (2Mg+2SO2
2MgO+MgS (2Mg+2SO2 2MgO+S Mg+S
2MgO+S Mg+S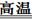 Mgs) (2分)
Mgs) (2分) 2MgO+C可知,镁和SO2反应生成物应该是氧化镁和单质硫,由于在高温下镁还可以继续和硫反应生成硫化镁,所以方程式为3Mg+SO2
2MgO+C可知,镁和SO2反应生成物应该是氧化镁和单质硫,由于在高温下镁还可以继续和硫反应生成硫化镁,所以方程式为3Mg+SO2 2MgO+MgS。
2MgO+MgS。

科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 操 作 |
| | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| | 欲证明溶液中含有SO42- | 滴入盐酸酸化的硝酸钡溶液 |
| | 欲证明溶液中含有S2- | 取少量溶液滴在醋酸铅试纸上看是否变黑 |
| | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| | 比较确定铜和镁的金属活动性强弱 | 用Pt作电极电解Mg(NO3)2、Cu( NO3)2混合液 |
| | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的PH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
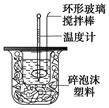
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯乙烷与NaOH溶液共热,在水解后的溶液中加入硫酸,再加入AgNO3溶液检验Cl-[ |
| B.将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 |
| C.实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 |
| D.向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。
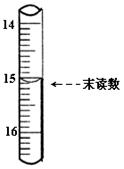
2Fe2O3+8SO2,进行以下实验,并测定该样品中FeS2样品的纯度(假设其它杂质不参与反应)。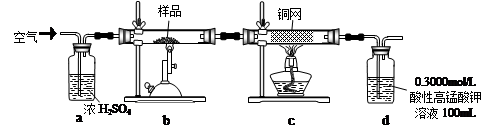
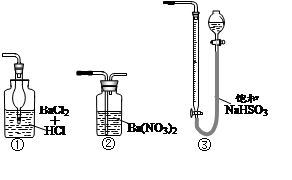
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
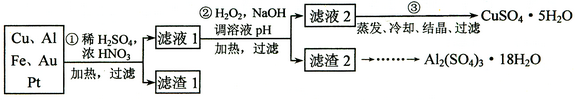
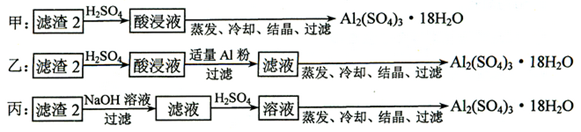
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
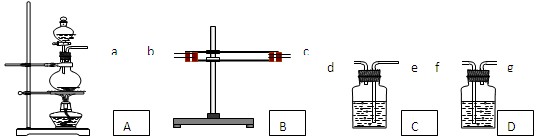
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com