
分析 (1)分别计算出两溶液中含有溶质的质量,然后根据质量分数的公式计算;
(2)先根据溶液的质量与密度的关系计算溶液的体积,再根据溶液的质量与质量分数求出溶质的质量,继而求出溶质的物质的量,根据物质的量浓度公式求出溶液的物质的量浓度.
解答 解:(1)20.0g质量分数为14.0%的KNO3溶液中溶质的质量为:20.0g×14.0%=2.8g,
30.0g质量分数为24.0%的KNO3溶液中含有溶质的质量为:30.0g×24.0%=7.2g,
溶液混合前后溶质、溶液的质量都不变,所以混合液的质量分数为:$\frac{2.8g+7.2g}{20g+30g}$×100%=20%.
答:混合后溶液的质量分数为20%;
(2)混合液中溶质的质量为:2.8g+7.2g=10.0g,溶质的物质的量为:n=$\frac{10g}{101g/mol}$≈0.1mol,
溶液的体积为V=$\frac{20g+30g}{1.26g/mL}$≈40mL=0.04L,
所以溶液的物质的量浓度为:c=$\frac{n}{V}$=$\frac{0.1mol}{0.04L}$=2.5mol/L,
答:混合后溶液的物质的量浓度为2.5 mol/L.
点评 本题考查了物质的量浓度、溶质的质量分数的计算,题目难度中等,注意物质的量浓度、溶质的质量分数计算方法,该题是高考中的常见考点和题型,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
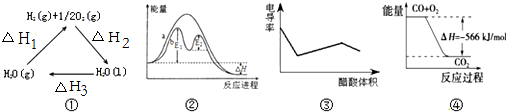
| A. | 图①中△H2=△H1+△H3 | |
| B. | 图②在催化剂条件下,反应的活化能等于E1+E2 | |
| C. | 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 3mol/LKCl溶液 | B. | 150m L 1mol/LAlCl3溶液 | ||
| C. | 50mL3mol/LMgCl2溶液 | D. | 75mL 1.5mol/LMgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能使溴水褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 蛋白质遇到硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡 常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
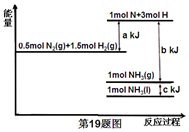
| A. | N2(g)+3H2(g)=2NH3(g)△H=-(b-a)kJ•mol-1 | |
| B. | N2(g)+3H2(g)=2NH3(g)△H=-(a-b)kJ•mol-1 | |
| C. | 2NH3(1)=N2(g)+3H2(g)△H=2(a+b-c)kJ•mol-1 | |
| D. | 2NH3(1)=N2(g)+3H2(g)△H=2(b+c-a)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com