
【题目】下列图示与对应的叙述相符的是
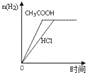

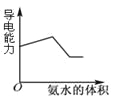
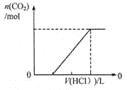
图1 图2 图3 图4
A.图1表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉
B.图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2
C.图3表示表示向盐酸和醋酸混合溶液中滴入氨水
D.图4表示在含等物质的量NaHCO3、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
【答案】D
【解析】
A、醋酸是弱酸,存在电离平衡,因此向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉产生的氢气体积相等,但盐酸反应速率比醋酸的反应速率快,A不正确;
B、向Ba(OH)2、KAlO2混合溶液中通入CO2,发生的反应分别是Ba(OH)2+CO2=BaCO3↓+H2O、2KAlO2+CO2+3H2O=2Al(OH)3↓+K2CO3、K2CO3+CO2+H2O=2KHCO3、BaCO3+CO2+H2O=Ba(HCO3)2,因此图2不能表示其反应过程,B不正确;
C、向盐酸和醋酸混合溶液中滴入氨水分别生成氯化铵、醋酸铵,溶液的导电性增强。当恰好反应后,溶液的导电性几乎不再发生变化,因此图3不能表示溶液的导电变化过程,C不正确;
D、碳酸钠与盐酸反应是分步进行的,因此向含等物质的量NaHCO3、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,发生反应的方程式分别为CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,因此产生气体的体积与消耗盐酸的关系可以用图4表示,D正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,在10 mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未两出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是( )
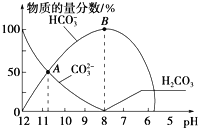
A.在0.1 mol/L Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.在B点所示的溶液中,浓度最大的离子是Na+
C.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
D.当溶液的pH为7时,溶液的总体积为20mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A. 当混合气体的平均相对分子质量保持不变时,反应达平衡
B. 增大压强,各物质的浓度不变
C. 升高温度,平衡常数K增大
D. 增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1molL-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1molL-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图。下列说法不正确的是( )

A.NaX溶液呈碱性B.P点:c(Na+)>c(H+)
C.M点:c(HX)+c(X-)=2c(Na+)D.M点水电离程度小于N点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | AG=lg[ | NH4+、Fe2+、I﹣、NO3- | 一定能大量共存 |
C | pH=1的溶液 | Fe2+、Al3+、 SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) ![]() 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
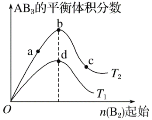
A. 若T2<T1,则正反应一定是放热反应
B. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
C. 达到平衡时A2的转化率大小为b>a>c
D. 若T2<T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:① 2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)![]() 2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)
2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
CO的燃烧热为________。CO将NO2还原为单质的热化学方程式为______________。
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g) ![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:酸性HCO3-<HClO<H2CO3)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填填“小于”,“大于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com