
����Ŀ�������������ڸ������������ӹ����жϼ���Ӧ�����ӷ���ʽ����ȷ���ǣ� ��
ѡ�� | ���� | ������ | ���ӹ����жϼ���Ӧ�����ӷ���ʽ |
A | �μӰ�ˮ | Na+��Al3+��Cl-��NO3- | ���ܴ������棬Al3++3OH-=Al(OH)3�� |
B | AG=lg[ | NH4+��Fe2+��I����NO3- | һ���ܴ������� |
C | pH=1����Һ | Fe2+��Al3+�� SO42-��MnO4- | ���ܴ������棬5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | ͨ������SO2���� | K+��Na+��ClO-��SO42- | ���ܴ������棬2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��������װ�ý����Ҵ���������ʵ�飮
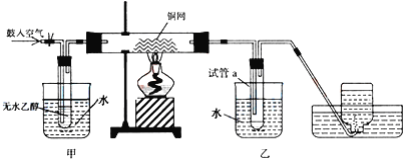
(1)�������Ӱ�װ��ϣ�����ʵ��ǰ��μ���װ�õ������ԣ�_____��
(2)ʵ�������ͭ�����ֵ�����________��
(3)��������ˮԡ���ò���ͬ����������__���ҵ�������__����
(4)��Ӧ����һ��ʱ����Թ�a�����ռ�����ͬ�����ʣ�������__������ƿ���ռ������������Ҫ�ɷ���__��
(5) ���Թ�a���ռ�����Һ����ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л�����_____��Ҫ��ȥ�����ʣ������ڻ��Һ�м���______(��д��ĸ)��Ȼ����ͨ��_____(��ʵ���������)���ɳ�ȥ��
a���Ȼ�����Һ b���� c��̼��������Һ d�����Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ���ʺͻ�ѧƽ���˵������ȷ���ǣ� ��
A.���ڻ�ѧ��Ӧ��˵����Ӧ����Խ�죬��Ӧ����һ��Խ����
B.N2(g)��3H2(g)![]() 2NH3(g) ��H��0��������������ʱ�������¶ȣ���Ӧ������(H2)��������ƽ��ת���ʾ�����
2NH3(g) ��H��0��������������ʱ�������¶ȣ���Ӧ������(H2)��������ƽ��ת���ʾ�����
C.��ѧ��Ӧ�������ۿ�ָ��������һ��ʱ���ڿ����Ʒ����ѧƽ�����ۿ�ָ������������ԭ�϶����Ʒ
D.CaCO3(s)=CaO(s)��CO2(g)�����²����Է����У�˵���÷�Ӧ�Ħ�H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������
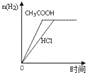

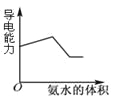
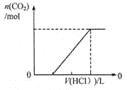
ͼ1 ͼ2 ͼ3 ͼ4
A.ͼ1��ʾ�������������ʵ���Ũ�ȵ�����ʹ�����Һ�У��ֱ��������þ��
B.ͼ2��ʾ��Ba(OH)2��KAlO2�����Һ��ͨ��CO2
C.ͼ3��ʾ��ʾ������ʹ�������Һ�е��백ˮ
D.ͼ4��ʾ�ں������ʵ���NaHCO3��Na2CO3�Ļ����Һ�еμ�0.1mol��L��1����������ʱ������������������������Ĺ�ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ���Ʊ���ص���Ҫԭ�ϡ������£�
���Ʊ���ص���Ҫԭ�ϡ������£�![]() ��Һ��pH��
��Һ��pH��![]() �ı仯��ͼ����ʾ��
�ı仯��ͼ����ʾ��![]() ��Һ��
��Һ��![]() �ķֲ�����
�ķֲ�����![]() ��pH�ı仯��ͼ����ʾ
��pH�ı仯��ͼ����ʾ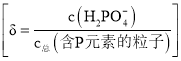 ��
��
�����й�![]() ��Һ��������ȷ����
��Һ��������ȷ���� ![]()
![]()
A.��Һ�д���3��ƽ��
B.��PԪ�ص�������![]() ��
��![]() ��
��![]()
C.��![]() ������Һ��pH���Ա�С
������Һ��pH���Ա�С
D.��Ũ�ȴ���![]() ��
��![]() ��Һ�ܽ�
��Һ�ܽ�![]() ����pH�ﵽ
����pH�ﵽ![]() ʱ��
ʱ��![]() ����ȫ��ת��Ϊ
����ȫ��ת��Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ת���ڸ�����������ʵ�ֵ���
����±����MgCl2��![]() Mg(OH)2
Mg(OH)2![]() MgCl2��Һ
MgCl2��Һ![]() Mg
Mg
��������![]()
![]()
![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3
��NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
��NaCl��Һ![]() Cl2����ˮ��
Cl2����ˮ��![]() FeCl2
FeCl2
��S![]() SO3
SO3![]() H2SO4
H2SO4
��SiO2![]() Na2SiO3��Һ
Na2SiO3��Һ![]() H2SiO3
H2SiO3
A.�ۢ�B.�ۢݢ�C.�٢ܢ�D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������û���̿���պ�����������ˮ�в����ĵ�Ũ�ȵ�(��Ҫ��I����ʽ���ڣ����ʲ����뷴Ӧ)��ʵ�������ͼ��ʾ������˵���������
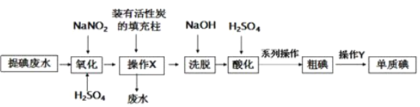
A.����X��Ŀ���Ǹ����ⵥ��
B.��ͨ������ķ����ᴿ�ֵ�
C.��ϴ�Ѻ����Һ�У����д�����I����![]()
D.�������跢����Ӧ�����ӷ���ʽΪ��6I��+2![]() +8H+��3I2+N2��+4H2O
+8H+��3I2+N2��+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ͨ����ͼ��ֱ�۵�������ѧ��Ӧ���̻���������ͼ����������ȷ����
A.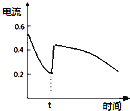 ��ʾ
��ʾ![]() ԭ��ط�Ӧ�����еĵ���ǿ�ȵı仯��tʱ���ܼ�����˫��ˮ
ԭ��ط�Ӧ�����еĵ���ǿ�ȵı仯��tʱ���ܼ�����˫��ˮ
B.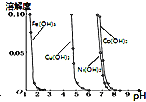 ��ͼ��֪������ͨ��������ҺpH�ķ�����ȥ
��ͼ��֪������ͨ��������ҺpH�ķ�����ȥ![]() ��Һ�е�
��Һ�е�![]() ��
��![]() ��
��![]()
C.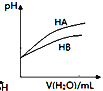 ��ʾ������ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯������ͬŨ������Һ��pH��
��ʾ������ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯������ͬŨ������Һ��pH��![]()
D.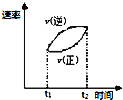 ��ʾ���淴Ӧ
��ʾ���淴Ӧ![]() ��
��![]() ����
����![]() ʱ�̼��ȣ�
ʱ�̼��ȣ�![]() ʱ�̴ﵽ��ƽ�⣬������ʱ��仯������ͼ
ʱ�̴ﵽ��ƽ�⣬������ʱ��仯������ͼ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��һ����Ҫ�Ļ���ԭ�ϣ���ϳɼ�Ӧ��һֱ���ܹ��ѧ�����ߵĹ�ע��N2��H2����NH3�ķ�ӦΪ��N2��g��+3H2(g) ![]() 2NH3(g) ��H=��92kJmol-1��
2NH3(g) ��H=��92kJmol-1��
��1����֪��N2(g)![]() 2N(g) ; H2(g)
2N(g) ; H2(g)![]() 2H(g)����Ͽ�1 mol N��H������Ҫ��������_____________kJ��
2H(g)����Ͽ�1 mol N��H������Ҫ��������_____________kJ��
��2����������ߺϳɰ�ƽ����ʵ�������_______________��
A������ B.���� C.��ѹ D.��ѹ E.����
��3����һ�����º�ѹ��������1 mol N2��3mol H2ģ��ϳɰ���Ӧ����ͼΪ��ͬ�¶���ƽ�������а����������������ѹǿ��p���Ĺ�ϵͼ��
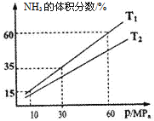
����ϵ��T1��60MPa�´ﵽƽ�⡣
����ʱƽ�ⳣ��Kp=___________ ����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ����������г�����ʽ���ɣ����軯��
��T1_____________T2������>������<������=������
�۴ﵽƽ������������г��������������ﵽ��ƽ��ʱ��c(H2)��______����������������С��������������
��4���ϳɰ���Ӧ�ڴ��������µķ�Ӧ����Ϊ��*��ʾ����̬����
��һ�� N2��g����2N*��H2��g����2H*������Ӧ��
�ڶ��� N*+H* ![]() NH*��NH*+H
NH*��NH*+H![]() NH2*��NH2* +H*
NH2*��NH2* +H*![]() NH3*�����췴Ӧ��
NH3*�����췴Ӧ��
������ NH3* ![]() NH3(g) ���췴Ӧ��
NH3(g) ���췴Ӧ��
�Ƚϵ�һ����Ӧ�Ļ��E1��ڶ�����Ӧ�Ļ��E2�Ĵ�С��E1__________E2������>������<������=�������ж�������________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com