
【题目】化学中通常用图象直观地描述化学反应进程或结果。下列图象及描述不正确的是
A.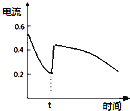 表示
表示![]() 原电池反应过程中的电流强度的变化,t时可能加入了双氧水
原电池反应过程中的电流强度的变化,t时可能加入了双氧水
B.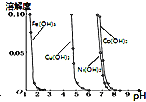 由图可知,可以通过调节溶液pH的方法除去
由图可知,可以通过调节溶液pH的方法除去![]() 溶液中的
溶液中的![]() 、
、![]() 、
、![]()
C.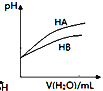 表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度下溶液的pH:
表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度下溶液的pH:![]()
D.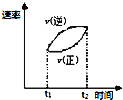 表示可逆反应
表示可逆反应![]() ,
,![]() ,在
,在![]() 时刻加热,
时刻加热,![]() 时刻达到新平衡,速率随时间变化的曲线图
时刻达到新平衡,速率随时间变化的曲线图
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | AG=lg[ | NH4+、Fe2+、I﹣、NO3- | 一定能大量共存 |
C | pH=1的溶液 | Fe2+、Al3+、 SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) ![]() 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
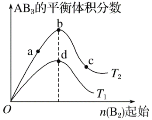
A. 若T2<T1,则正反应一定是放热反应
B. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
C. 达到平衡时A2的转化率大小为b>a>c
D. 若T2<T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将KCl和CuSO4两种溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图所示,则下列说法正确的是
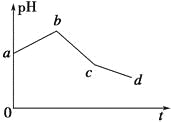
A.整个过程中两电极反应2Cl--2e-=Cl2↑、2H++2e-=H2↑不可能同时发生
B.电解至c点时,往电解液中加入适量CuCl2固体,即可使电解液恢复至原来的浓度
C.ab段表示电解过程中H+被还原,pH上升
D.原混合溶液中KCl和CuSO4的浓度之比恰好为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是

A. 在0.1 mol/L Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B. 当溶液的pH为7时,溶液的总体积为20 mL
C. 在B点所示的溶液中,浓度最大的阳离子是Na+
D. 在 A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. lmol 该有机物( )最多能与4mol 氢气加成
)最多能与4mol 氢气加成
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 乳酸薄荷醇酯( )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
D.  分子中至少有9个碳原子处于同一平面上
分子中至少有9个碳原子处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。已知:① 2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)
2CO2(g) ΔH=566.0 kJ/mol,② N2(g)+O2(g)![]() 2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g)
2NO(g) ΔH=+180.5 kJ/mol,③ 2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
2NO2(g) ΔH=116.5 kJ/mol。 回答下列问题:
CO的燃烧热为________。CO将NO2还原为单质的热化学方程式为______________。
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g) ![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:酸性HCO3-<HClO<H2CO3)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填填“小于”,“大于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正己烷是优良的有机溶剂,其某种模型如图所示。下列有关说法正确的是( )

A.正己烷的分子式为![]()
B.正己烷的一氯代物有3种
C.正己烷能与溴水发生取代反应而使溴水褪色
D.正己烷中的所有碳原子位于同一条直线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com