
【题目】正己烷是优良的有机溶剂,其某种模型如图所示。下列有关说法正确的是( )

A.正己烷的分子式为![]()
B.正己烷的一氯代物有3种
C.正己烷能与溴水发生取代反应而使溴水褪色
D.正己烷中的所有碳原子位于同一条直线
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】化学中通常用图象直观地描述化学反应进程或结果。下列图象及描述不正确的是
A.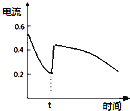 表示
表示![]() 原电池反应过程中的电流强度的变化,t时可能加入了双氧水
原电池反应过程中的电流强度的变化,t时可能加入了双氧水
B.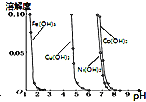 由图可知,可以通过调节溶液pH的方法除去
由图可知,可以通过调节溶液pH的方法除去![]() 溶液中的
溶液中的![]() 、
、![]() 、
、![]()
C.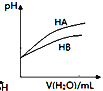 表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度下溶液的pH:
表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度下溶液的pH:![]()
D.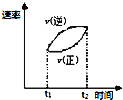 表示可逆反应
表示可逆反应![]() ,
,![]() ,在
,在![]() 时刻加热,
时刻加热,![]() 时刻达到新平衡,速率随时间变化的曲线图
时刻达到新平衡,速率随时间变化的曲线图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,其合成及应用一直备受广大化学工作者的关注。N2和H2生成NH3的反应为:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92kJmol-1。
2NH3(g) △H=-92kJmol-1。
(1)已知:N2(g)![]() 2N(g) ; H2(g)
2N(g) ; H2(g)![]() 2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
(2)有利于提高合成氨平衡产率的条件是_______________。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
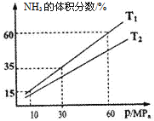
若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;列出计算式即可,无需化简)。
②T1_____________T2(填“>”、“<”或“=”)。
③达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将______(填“增大”“减小”或“不变”)
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g)→2N*;H2(g)→2H*(慢反应)
第二步 N*+H* ![]() NH*;NH*+H
NH*;NH*+H![]() NH2*;NH2* +H*
NH2*;NH2* +H*![]() NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* ![]() NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________E2(填“>”、“<”或“=”),判断理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下:
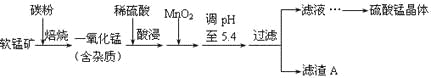
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 10.4 |
(1)一氧化锰用硫酸酸浸时发生的主要反应的离子方程式为____________________。酸浸后加入MnO2将溶液中的Fe2+氧化成Fe3+,其目的是___________。
(2)滤渣A的成分除MnO2外,还有_______________。
(3)MnO2是制造碱性锌锰电池的基本原料,放电时负极的电极反应式为________。工业上以石墨为电极电解酸化的MnSO4溶液生产MnO2,阳极的电极反应式为_________,当阴极产生4.48L(标况)气体时,MnO2的理论产量为______g。
(4)锰的三种难溶化合物的溶度积:Ksp(MnCO3)=1.8×10-11,Ksp[Mn(OH)2]=1.9×10-13,Ksp(MnS)=2.0×10-13,则上述三种难溶物的饱和溶液中,Mn2+浓度由大到小的顺序是_______>_______>_______(填写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组以难溶性钾长石(K2OAl2O36SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:
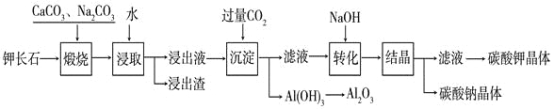
(1)煅烧过程中钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式是:______________________________。
(2)已知NaAlO2和KAlO2易发生如下水解反应:AlO2—+ 2H2O![]() Al(OH)3 + OH— ,“浸取”时应保持溶液呈___________性(填“酸”或“碱”)。
Al(OH)3 + OH— ,“浸取”时应保持溶液呈___________性(填“酸”或“碱”)。
(3)“转化”时加入NaOH的主要作用是______________________________(用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______________、_______________和水。
(5)以Al2O3为原料,以石墨为电极,通过电解法可制得金属铝。电解池中接电源负极的一极的电极反应式是___________________。长时间电解后,需要更换新的石墨电极的是________极(填“阴”或“阳”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一个5L的密闭容器中发生反应![]() ,该反应的平衡常数和温度的关系如下:
,该反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
①该反应的平衡常数表达式K=__________,
②该反应的![]() _________0 (填“>”“<”或“=”)。
_________0 (填“>”“<”或“=”)。
③ 判断该反应是否达到平衡的依据为(_______)
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
E. 气体的平均相对分子质量不随时间改变
④1200℃时反应![]() 的平衡常数的值为______________。
的平衡常数的值为______________。
⑤830℃时,充入2.0mol的A和8.0mol的B,如反应初始6s内A的平均反应速率v(A)=0.03mol/(L· s)则6s时c(A)=___________![]() ,C的物质的量为__________mol;若反应经一段时间后,达到平衡时A的转化率为____________,如果这时向该密闭容器中再充入1mol氩气(氩气不参与该反应),平衡时A的转化率将____________(填“增大”“减小” 或“不变”), 如果这时向该密闭容器中再充入1.0mol的A和4.0mol的B, 平衡时A的转化率将____________(填“增大”“减小” 或“不变”)。
,C的物质的量为__________mol;若反应经一段时间后,达到平衡时A的转化率为____________,如果这时向该密闭容器中再充入1mol氩气(氩气不参与该反应),平衡时A的转化率将____________(填“增大”“减小” 或“不变”), 如果这时向该密闭容器中再充入1.0mol的A和4.0mol的B, 平衡时A的转化率将____________(填“增大”“减小” 或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg ![]() 的变化关系如图所示。下列叙述正确的是( )
的变化关系如图所示。下列叙述正确的是( )

A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH-):a<b
C.相同温度下,电离常数K(HX):a>b
D.lg ![]() =3,若同时微热两种溶液,则
=3,若同时微热两种溶液,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)![]() pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
pCg)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化,②体系的密度不再发生变化,③各组分的物质的量浓度不再改变,④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是( )
A.只有③④B.②③④C.①②③④D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是

A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com