
【题目】下列物质的转化在给定条件下能实现的是
①盐卤(含MgCl2)![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() Mg
Mg
②铝土矿![]()
![]()
![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3
③NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
④NaCl溶液![]() Cl2(无水)
Cl2(无水)![]() FeCl2
FeCl2
⑤S![]() SO3
SO3![]() H2SO4
H2SO4
⑥SiO2![]() Na2SiO3溶液
Na2SiO3溶液![]() H2SiO3
H2SiO3
A.③⑥B.③⑤⑥C.①④⑤D.①③⑥
【答案】A
【解析】
①盐卤(含MgCl2)与石灰乳反应生成氢氧化镁沉淀,氢氧化镁与盐酸反应生成氯化镁溶液,电解氯化镁溶液得不到镁,应电解熔融的MgCl2得到Mg,故①错误;
②氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液中加入足量的盐酸,生成氯化铝,得不到氢氧化铝,故②错误;
③氨催化氧化生成一氧化氮和水,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,符合各步转化,故③正确;
④电解氯化钠溶液生成氢气、氢氧化钠和氯气,氯气与铁反应只能生成氯化铁,得不到氯化亚铁,故④错误;
⑤硫在氧气中燃烧只能生成二氧化硫,不能生成三氧化硫,故⑤错误;
⑥SiO2与氢氧化钠反应Na2SiO3,Na2SiO3中通二氧化碳发生反应生成H2SiO3,符合各步转化,故⑥正确;
故③⑥正确,故选A。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随加入的c(HC2O4-)的变化趋势如图所示。下列说法正确的是( )
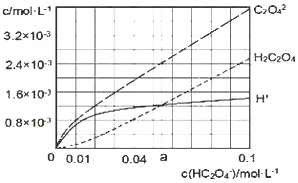
A.当c(HC2O4-)=0.1 mol/L时,c(H+)>c(C2O42-)-c(H2C2O4)
B.当c(HC2O4-)>a mol/L时,c(H+)<c(H2C2O4),HC2O4-的水解程度大于电离程度
C.HC2O4-![]() C2O42-+H+,Ka(HC2O4-)=a
C2O42-+H+,Ka(HC2O4-)=a
D.将0.08 mol/LH2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A. 当混合气体的平均相对分子质量保持不变时,反应达平衡
B. 增大压强,各物质的浓度不变
C. 升高温度,平衡常数K增大
D. 增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡状态的是( )
A. 2v(NH3)=v(CO2) B. 密闭容器中c(NH3)∶c(CO2)=2∶1
C. 密闭容器中混合气体的密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | AG=lg[ | NH4+、Fe2+、I﹣、NO3- | 一定能大量共存 |
C | pH=1的溶液 | Fe2+、Al3+、 SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将硫酸亚铁装入下图所示的装置a中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是
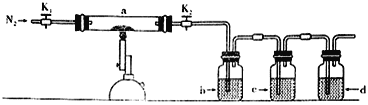
A. 分解的气体产物中有SO3、SO2,应该先检验SO3
B. 装置b中的试剂为Ba(NO3)2溶液,反应后有白色沉淀生成
C. 装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2
D. 装置d中的试剂为石灰水,是尾气处理装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) ![]() 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断不正确的是( )
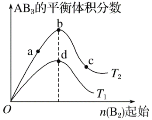
A. 若T2<T1,则正反应一定是放热反应
B. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
C. 达到平衡时A2的转化率大小为b>a>c
D. 若T2<T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是

A. 在0.1 mol/L Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B. 当溶液的pH为7时,溶液的总体积为20 mL
C. 在B点所示的溶液中,浓度最大的阳离子是Na+
D. 在 A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.由水电离出的c(H+)=10-13molL-1的溶液:K+、Ba2+、Cl-、CO32-
B.使酚酞变红的溶液:Na+、Cl-、SO42-、Fe3+
C.常温下![]() =1012的溶液中:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液中:Fe2+、Mg2+、NO3-、Cl-
D.0.1molL-1盐酸的澄清透明溶液中:Fe3+、K+、SO42-、Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com