
随着化石能源的减少,新能源的开发利用日益迫切。
(1)Bunsen热化学循环制氢工艺由下列三个反应组成:
SO2(g)+I2(g)+2H2O(g)=2HI (g)+H2SO4(l) ΔH=a kJ·mol-1
2H2SO4(l)=2H2O(g)+2SO2(g)+O2(g) ΔH=b kJ·mol-1
2HI(g)=H2(g)+I2(g) ΔH=c kJ·mol-1
则:2H2O(g)=2H2(g)+O2(g) ΔH= kJ·mol-1
(2) 已知在101 kPa时,CH4完全燃烧生成1mol液态水,放出的热量为QkJ,则CH4完全燃烧反应的热化学方程式是: 。
(3)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放 kJ的能量。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
高富氧底吹熔池炼铜新工艺反应炉如图
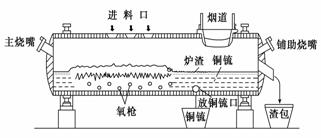
(1)该新工艺的优点之一是混合矿料不需要干燥、磨细。烟气进入余热锅炉后,经静电除尘后进入酸厂回收利用,这样做体现化学的________思想。
(2)该新工艺的优点之二是首次投料需要添加少量的燃料,当反应充分启动后就不需要再投放燃料,说明反应炉中的反应总体来说是________反应。
(3)此法冶炼的矿石主要是黄铜矿(主要成分是CuFeS2),经过上面设备煅烧后最终化合态的铜生成铜和SO2,在冶炼铜矿过程中存在重要反应:2CuFeS2+O2=Cu2S+2FeS+SO2、2Cu2S+3O2=2Cu2O+2SO2、________________________________。
(4)从放铜锍口放出的铜锍中还含有铁和硫必须除去,铜锍吹炼过程是火法冶炼生产粗铜的最后一道工序,吹炼过程分为两个阶段。第一阶段的任务是使铁氧化造渣,主要化学反应为:①2FeS+3O2+SiO2=2FeO·SiO2+2SO2 ,第二阶段是使上一个阶段中没有反应彻底的Cu2S氧化成粗铜,主要化学反应为:②Cu2S+O2=2Cu+SO2,下列关于反应①、②的分析正确的是________(填序号)
A.反应②氧化剂只有O2
B.硫元素在①和②均被氧化
C.①和②在反应过程中都有共价键破坏和共价键形成
(5)图中渣包中的炉渣含有Fe2O3、FeO 、SiO2等,选用提供的试剂设计实验验证炉渣中含有FeO。提供的试剂:KMnO4溶液、KSCN溶液、NaOH溶液、稀硫酸、稀盐酸,所选试剂为_______________。实验现象是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,对于反应:N2(g)+3H2 2NH3(g),在反应起始时N2和H2分别为10mol和30mol,当达到平衡时,N2的转化率为30%。若以NH3为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则NH3的起始物质的量和NH3的转化率正确的是
2NH3(g),在反应起始时N2和H2分别为10mol和30mol,当达到平衡时,N2的转化率为30%。若以NH3为起始反应物,反应条件与上述反应相同时,欲使其达到平衡时各成分的百分含量与前者相同,则NH3的起始物质的量和NH3的转化率正确的是
A. 20mol;70% B. 20mol;30% C. 40mol;35% D. 10mol;50%
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下, 将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中, 在催化剂存在下进行下列反应: 2SO2(g) + O2(g)  2SO3(g); △H= -197 kJ/ mol, 当达到平衡状态时, 下列说法中正确的是
2SO3(g); △H= -197 kJ/ mol, 当达到平衡状态时, 下列说法中正确的是
A.生成 SO3 为2 mol B.反应放出 197 kJ 的热量
C.SO2 和 SO3 物质的量之和一定为 2mol
D.SO2 的物质的量和SO3 物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是 ( )。
A.常温下,4 g CH4含有NA个C—H共价键
B.1 mol Fe 与足量的稀HNO3反应,转移2NA个电子
C.1 L 0.1 mol·L-1 NaHCO3溶液中含有0.1NA 个HCO3-
D.常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )。
A.3.9 g Na2O2固体中所含的离子数为0.2NA,所含的共价键数为0.05NA
B.14 g C2H4和C3H6的混合物中,所含H原子数为2NA
C.PCl3、NO2、BF3、HClO这些分子中每个原子都达到了8电子稳定结构
D.电解精炼铜时,当阳极减少3.2 g铜时,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在溶液中加入足量Na2O2后仍能大量共存的离子组是 ( )。
A.NH4+、Ba2+、Cl-、NO3-
B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3-
D.Na+、Cl-、CO32-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是________,有关的离子方程式为______________________________________________________________。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有________,有关的离子方程式为____________________________。
(4)原溶液可能大量存在的阴离子是下列的________。
A.Cl- B.NO3- C.CO32- D.OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com