
【题目】黄血盐[亚铁氰化钾,K4[Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mgkgˉ1。一种制备黄血盐的工艺如下:

回答下列问题:
(1)步骤Ⅰ反应的化学方程式为____________。
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为(填化学式)___________________。
(3)步骤Ⅴ所用的试剂X是______________________。
【答案】6HCN+3Ca(OH)2+FeSO4=Ca2Fe(CN)6+CaSO4↓+6H2O Ca Cl2(KCl可答) K2CO3
【解析】
本题制备黄血盐的流程先由石灰乳、硫酸亚铁和HCN溶液制得Ca2[Fe(CN)6],过滤除去CaSO4后加入KCl,制得K2Ca[Fe(CN)6],再经过滤除去废液,加入试剂以除去钙并生成K4[Fe(CN)6],再经一系列分离操作获得K4[Fe(CN)6]·3H2O。可在此基础上,解答各小题。
(1)根据流程图,步骤I中投入物质为石灰乳、FeSO4、HCN,生成的物质为Ca2Fe(CN)6,Ca2Fe(CN)6中CN显-1价,Ca显+2价,Fe显+2价,步骤I中没有化合价的变化,因此有Ca(OH)2+FeSO4+HCN→Ca2Fe(CN)6,SO42-与部分Ca2+结合生成微溶的CaSO4形成沉淀,因此反应方程式为 6HCN+3Ca(OH)2+FeSO4=Ca2Fe(CN)6+CaSO4↓+6H2O。答案为: 6HCN+3Ca(OH)2+FeSO4=Ca2Fe(CN)6+CaSO4↓+6H2O;
(2)根据步骤III,加入KCl制备K2CaFe(CN)6,2个K+替代了一个Ca2+,滤液中含有的溶质为CaCl2,以及过量的KCl;答案为:CaCl2(KCl可答);
(3)根据流程目的,同时为了不引入新的杂质,应加入含K+的物质,步骤V是脱钙,试剂X中应含有能与Ca2+结合的阴离子,因此加入试剂X应为K2CO3;答案为:K2CO3


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】锌与100mL18.5mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol·L-1。请计算:
(1)反应中共消耗H2SO4的物质的量为__。
(2)反应中共消耗Zn的质量为__。
(3)气体的成分及物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
(1)反应Ⅰ的化学平衡常数表达式是K=_______________________________。
(2)一定温度下,在容积可变的密闭容器中进行反应Ⅱ,不能确定上述可逆反应已达到化学平衡状态的是_____________
A.体系的体积不再发生变化 B.生成n mol CO的同时消耗n mol H2O
C.混合气的密度不再改变 D.1 mol H—H键断裂的同时断裂2 mol H—O键
(3)某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同的反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
①对比表中①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因________________________________;
②对比表中①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因___________________________________________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有____________。
a.使用Cu/ZnO纳米棒做催化剂 b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度 d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
(4)反应混合气体经过降温加压可分离出甲醇,剩余气体可再次充入反应器继续反应,经过多次循环往复后混合气体中CO的含量已经很高,可以在另外容器中在合适的催化剂条件下使CO和H2反应合成CH3OH(g),写出该反应的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以对氨基水杨酸和乙炔为主要原料,按下列路线合成便秘治疗药物——琥珀酸普卡必利。
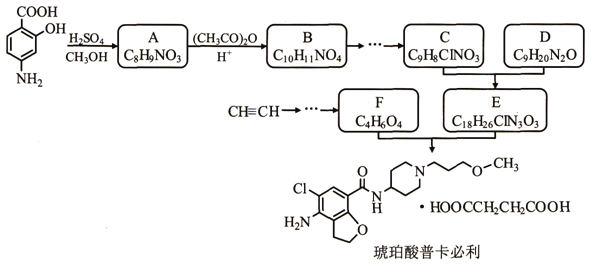
已知:①化合物B中含有羟基;
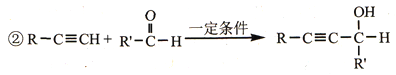
请回答:
(1)下列说法不正确的是_________
A.对氨基水杨酸能发生缩聚反应生成高分子化合物
B.化合物B能发生氧化反应,不能发生还原反应
C.化合物C能形成内盐
D.化合物F能与NaHCO3溶液反应
(2)化合物B的结构简式是_________。
(3)C+D→E的化学方程式是____________。
(4)写出同时符合下列条件的A 的所有同分异构体的结构简式_________。
①分子中含有硝基且直接连在苯环上
②1H-NMR谱显示苯环上有两种示同花学环境的氢原子
③不能与FeCl3溶液发生显色反应
(5)设计以乙炔和甲醛为原料制备化合物F的合成路线(用流程图表示,无机试剂任选)_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组在FeO催化下,利用回收资源CO2进行科研。工艺如下所示。
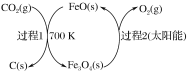
(1)完成有太阳能参与的反应式是______________。
(2)过程1改为电解, FeO电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列有关说法正确的是
2C(g)+D(g)经2 min B的浓度减少0.6 mol·L-1。下列有关说法正确的是
①用A表示的反应速率是0.4 mol·L-1·min-1
②在2 min末时,反应物B的反应速率是0.3 mol·L-1·min-1
③在这2 min内用C表示的平均速率为0.2 mol·L-1·min-1
④在2 min时,B、C、D的浓度比一定为3∶2∶1
⑤若D的起始浓度为0.1 mol·L-1,则2 min时D的浓度为0.3 mol·L-1
A. ①②③B. ②④C. ④⑤D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性条件下,黄铁矿(FeS2)催化氧化的反应方程式为2FeS2 + 7O2+ 2H2O ═ 2Fe2+ + 4SO42 + 4H+。实现该反应的物质间转化如图所示。下列分析正确的是
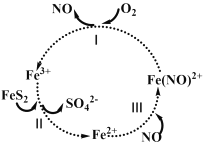
A.在酸性条件下,黄铁矿催化氧化中NO作催化剂
B.反应Ⅱ中Fe3+作氧化剂,FeS2被还原
C.反应Ⅰ的离子方程式为4Fe(NO)2+ + O2+ 4H+ ═ 4Fe3+ +4NO + 2H2O,Fe(NO)2+作氧化剂
D.反应Ⅲ的离子方程式为Fe2+ + NO ═Fe(NO)2+,该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草药中有一种色素,它的结没食子儿茶素的结构简式如图,它是目前尚不能人工合成的纯天然、高效能的抗氧化剂.下列关于该物质的叙述正确的是( )
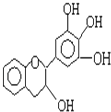
A.分子式为C15H12O5
B.1 mol 该物质与4mol NaOH恰好完全反应
C.该物质在浓硫酸作用下可发生消去反应
D.该物质可以和溴水发生取代反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2。某校化学研究小组利用下图实验装置检验产物中的H2和CO(设气体均被充分吸收)。下列有关说法正确的是

A. ②、③、⑤中依次盛装澄清石灰水、浓硫酸和氢氧化钠溶液
B. 为了实验安全性,应先点燃①处酒精灯,后点燃④处酒精灯
C. 当黑色氧化铜变红色,即可证明产物中一定含有H2 和CO
D. 若用碱石灰替换无水硫酸铜,也可达到检验H2 和CO目的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com