
【题目】下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)
D.水电离出的H+和OH-与盐中弱离子结合,造成盐溶液呈酸碱性
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度(假设Zn2+浓度为10-5 mol·L-1时,Zn2+已沉淀完全)。下列说法不正确的是( )
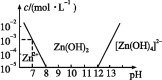
A.往ZnCl2溶液中加入足量氢氧化钠溶液,离子方程式为Zn2++4OH-![]() [Zn(OH)4]2-
[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17
C.某废液中含Zn2+,沉淀Zn2+可以控制溶液pH的范围是8~12
D.向1 L 1 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然油脂结构的核心为甘油[HOCH2CH(OH)CH2OH],有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11)。该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如下图所示(注意图中的反应式不完整)。
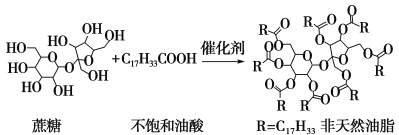
下列说法正确的是( )
A.蔗糖酯也是高级脂肪酸的甘油酯,属于油脂类物质
B.该非天然油脂与氢氧化钠溶液共热,其水解产物不与溴水反应
C.非天然油脂为高分子化合物
D.该蔗糖酯在稀硫酸的作用下水解,最终可生成三种有机化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+,而可能含有Fe2+,进行如下实验操作时最佳顺序为
①加入足量的氯水 ②加入足量酸性KMnO4溶液 ③加入少量KSCN溶液
A. ①③B. ③②C. ③①D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.含氧酸能起氧化作用,无氧酸则不能
B.阳离子只有氧化性,阴离子只有还原性
C.失电子难的原子获得电子的能力一定强
D.化学反应中,某元素由化合态变成游离态,此元素可能被氧化,也可能被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KHSO4溶液显________性,用离子方程式表示为_______________。室温时KHCO3溶液的pH________7(填“>”“<”或“=”),用离子方程式表示为________________。将上述两种溶液混合,现象是________,离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,电离常数Ka(HX)=3.6×10﹣4 , 溶度积常数Ksp(CaX2)=1.46×10﹣10 . 现向1L 0.2mol/LHX溶液中加入1L 0.2mol/LCaCl2溶液,则下列说法中正确的是( )
A.25℃时,0.1 mol/LHX溶液中pH=1
B.Ksp(CaX2)随温度和浓度的变化而变化
C.该体系中,c(Cl﹣)=c(Ca2+)
D.该体系中HX与CaCl2反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列氧化还原反应中,氧化剂与还原剂的物质的量之比不为1:2的是( )
A.3NO2+H2O═2HNO3+NO
B.I2+2NaClO3═2NaIO3+Cl2
C.SiO2+3C═SiC+2CO↑
D.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,水的离子积为Kw,该温度下将a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,要使混合液呈中性,必要的条件是
A. 混合液中c(H+)=![]() w B. 混合液的pH=7
w B. 混合液的pH=7
C. a=b D. 混合液中c(B+)=c(A-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com