
【题目】(1)偏铝酸钠的水溶液呈___(填“酸”“中”或“碱”)性,原因是(用离子方程式表示):________________;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____(填“促进”或“抑制”)其水解。
(2)明矾可用于净水,原因是(离子方程式表示):__________________。
(3)用离子方程式表示泡沫灭火器灭火原理:__________________。
(4)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示):____________。
(5)碳酸氢钠溶液中离子浓度由大到小的顺序是:__________________。
【答案】 碱 AlO2-+ 2H2O =Al(OH)3 + OH- 抑制 Al3++3H2O![]() Al(OH)3(胶体)+3H+ Al3+ + 3HCO3- == Al(OH)3↓+3CO2↑ CO32- +H2O =HCO3- + OH- [Na+]>[HCO3-]>[OH-]>[CO32-]>[H+]
Al(OH)3(胶体)+3H+ Al3+ + 3HCO3- == Al(OH)3↓+3CO2↑ CO32- +H2O =HCO3- + OH- [Na+]>[HCO3-]>[OH-]>[CO32-]>[H+]
【解析】(1)偏铝酸钠的水溶液呈碱性,原因是偏铝酸钠在水中发生了水解,离子方程式为:AlO2- + 2H2O![]() Al(OH)3 + OH-;实验室在配制AgNO3溶液时,溶液中的银离子水解显酸性,Ag++H2O
Al(OH)3 + OH-;实验室在配制AgNO3溶液时,溶液中的银离子水解显酸性,Ag++H2O![]() AgOH+H+,为抑制银离子的水解通常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度;
AgOH+H+,为抑制银离子的水解通常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度;
(2)明矾溶于水,铝离子水解形成氢氧化铝胶体能吸附水中的悬浮颗粒并沉降下来达到净水的目的,离子方程式为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(3)泡沫灭火器原理是NaHCO3与Al2(SO4)3发生双水解反应,离子方程式为:Al3+ + 3HCO3- == Al(OH)3↓+3CO2↑;
(4)纯碱可代替洗涤剂洗涤餐具是因为碳酸钠水解显碱性,使油脂在碱性溶液中水解生成溶于水的物质而洗去,离子方程式为:CO32- +H2O ![]() HCO3- + OH-;
HCO3- + OH-;
(3)在碳酸氢钠溶液中,离子间存在着这样的关系HCO3-+H2O![]() H2CO3+OH-,HCO3-
H2CO3+OH-,HCO3-![]() H++CO32-,H2O
H++CO32-,H2O![]() H++OH-;由于HCO3-水解大于电离,说明碳酸氢钠溶液显碱性,且c(OH-) > c(CO32-),由于少部分水解和电离,则c(Na+)>c(HCO3-)>c(OH-)> c(CO32-),又由于 c(HCO3-) 产生的c(H+)与c(CO32-)数目相等,而水H2O电离也产生c(H+)。因此 c (H+) > c(CO32-),碳酸氢钠溶液中,离子浓度由大到小的顺序是:c(Na+)>c(HCO3-)>c(OH-)> c(H+) > c(CO32-)。
H++OH-;由于HCO3-水解大于电离,说明碳酸氢钠溶液显碱性,且c(OH-) > c(CO32-),由于少部分水解和电离,则c(Na+)>c(HCO3-)>c(OH-)> c(CO32-),又由于 c(HCO3-) 产生的c(H+)与c(CO32-)数目相等,而水H2O电离也产生c(H+)。因此 c (H+) > c(CO32-),碳酸氢钠溶液中,离子浓度由大到小的顺序是:c(Na+)>c(HCO3-)>c(OH-)> c(H+) > c(CO32-)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计从模拟海水中制备MgO的实验方案:
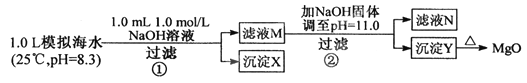
模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
【注】溶液中某种离子的浓度小于1.0![]() 10-5mol
10-5mol![]() L-,可认为该离子不存在。
L-,可认为该离子不存在。
实验过程中,假设溶液体积不变。已知:
Ksp(CaCO3)=4.96![]() 10-9 Ksp(MgCO3)=2.1
10-9 Ksp(MgCO3)=2.1![]() 10-5
10-5
Ksp(Ca(OH)2)=4.68![]() 10-6 Ksp(Mg(OH)2)=5.61
10-6 Ksp(Mg(OH)2)=5.61![]() 10-12
10-12
下列说法正确的是
A. 沉淀物x为CaCO3
B. 滤液M中存在Mg2+ ,不存在Ca2+
C. 滤液N中存在Mg2+ , Ca2+
D. 步骤②中应改为加入4.2g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g)![]() -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g )![]() N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g) ![]() 2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g)![]() 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g) ![]() 2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
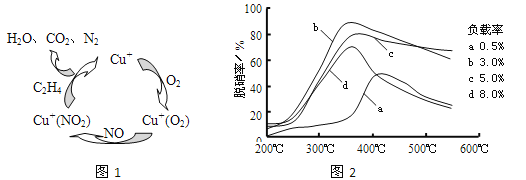
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
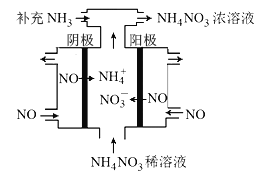
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关AgCl沉淀的溶解平衡的说法中正确的是( )
A.AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度减小
D.在有AgCl沉淀生成的溶液中加入NaCl固体,AgCl沉淀溶解的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各对物质属于同系物的是( )
A. CH2=CHCH3和CH2=CH2 B. CH2ClCH3和CH2ClCH(CH3)CH2Cl
C. CH2=CH2和![]() D. 12C和14C
D. 12C和14C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是( )
A. K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大
B. 比较Ksp与离子积Qc的相对大小,可判断难溶解电解质在给定条件下沉淀能否生成或溶解
C. K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了
D. 弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka·Kh
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种化合物,分别由K+、Ba2+、SO42—、CO32、OH—中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D的化学式。
A、________,B、________,C、________,D、________。
(2)写出下列反应的离子方程式。
B与盐酸反应:_______________________________________________,
C与硫酸反应:_______________________________________________,
E(少量)与澄清石灰水反应:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有KI,NaBr的混合溶液中通入过量的Cl2充分反应.将溶液蒸干并灼烧,最后剩余的固体物质是( )
A.KI和NaBr
B.KCl和NaCl
C.KCl和NaBr
D.KCl、NaCl和I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒 ﹣
B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢
D.空气、氮气、胆矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com