
【题目】某温度下,在一密闭容器中发生如下可逆反应:![]() ;
;![]() 若起始时E浓度为a
若起始时E浓度为a![]() ,F、G浓度均为0,达平衡时E浓度为0.5a
,F、G浓度均为0,达平衡时E浓度为0.5a![]() ;若E的起始浓度改为2a
;若E的起始浓度改为2a![]() ,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是
A.升高温度时,正反应速率加快、逆反应速率减慢
B.若![]() ,容器体积保持不变,新平衡下E的体积分数为
,容器体积保持不变,新平衡下E的体积分数为![]()
C.若![]() ,容器体积保持不变,新平衡下F的平衡浓度小于
,容器体积保持不变,新平衡下F的平衡浓度小于![]()
![]()
D.若![]() ,容器压强保持不变,新平衡下E的物质的量为amol
,容器压强保持不变,新平衡下E的物质的量为amol
【答案】B
【解析】
A、升高温度正、逆反应速率都增大;
B、容器体积保持不变,![]() ,反应前后气体的物质的量不变,若E的起始浓度改为2a
,反应前后气体的物质的量不变,若E的起始浓度改为2a![]() ,等效为增大压强,平衡不移动,新平衡下E的体积分数与原平衡相等;
,等效为增大压强,平衡不移动,新平衡下E的体积分数与原平衡相等;
C、容器体积保持不变,若E的起始浓度改为2a![]() ,等效为在原平衡的基础上增大E的浓度,反应向正反应进行,F的浓度增大;
,等效为在原平衡的基础上增大E的浓度,反应向正反应进行,F的浓度增大;
D、题目中为物质的量的浓度,不能确定物质具体物质的量.
A、升高温度正、逆反应速率都增大,故A错误;
B、容器体积保持不变,![]() ,反应前后气体的物质的量不变,若E的起始浓度改为2a
,反应前后气体的物质的量不变,若E的起始浓度改为2a![]() ,等效为增大压强,平衡不移动,平衡时E的转化率不变,新平衡下E的体积分数与原平衡相等为
,等效为增大压强,平衡不移动,平衡时E的转化率不变,新平衡下E的体积分数与原平衡相等为![]() ,故B正确;
,故B正确;
C、原平衡时E浓度为0.5a![]() ,
,![]() mol/L-0.5amol/L=0.5a
mol/L-0.5amol/L=0.5a![]() ,故平衡时F的浓度为0.5a
,故平衡时F的浓度为0.5a![]() ,容器体积保持不变,若E的起始浓度改为2a
,容器体积保持不变,若E的起始浓度改为2a![]() ,等效为在原平衡的基础上增大E的浓度,反应向正反应进行,F的浓度增大,故大于0.5a
,等效为在原平衡的基础上增大E的浓度,反应向正反应进行,F的浓度增大,故大于0.5a![]() ,故C错误;
,故C错误;
D、容器压强保持不变,若E的起始浓度改为2a![]() ,与原平衡为等效平衡,E的转化率相同,平衡时E的物质的量为原平衡的2倍,题目中为物质的量的浓度,不能确定物质的量,原平衡E的物质的量不一定是
,与原平衡为等效平衡,E的转化率相同,平衡时E的物质的量为原平衡的2倍,题目中为物质的量的浓度,不能确定物质的量,原平衡E的物质的量不一定是![]() ,故D错误;
,故D错误;
故选B。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
(沉淀制备)取一定量胆矾(CuSO4·5H2O)溶于水,再滴几滴稀硫酸,充分搅拌后得到一定体积的CuSO4溶液。向其中加适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)用无水乙醇洗涤的目的是________。
(实验探究)同学们设计了如下装置,用制得的蓝绿色固体进行实验:
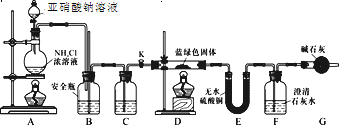
(2)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生的N2将装置中的空气排除,避免干扰。C中盛装的试剂应是________。
(3)装置A中发生反应的离子方程式为________。
(4)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是________。
(5)同学们查阅文献知:Ksp(CaCO3)=2.8×10-9,Ksp(BaCO3)=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是________。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是________。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用20g烧碱配制成500mL溶液。
(1)所得溶液的物质的量浓度为多少?(写出计算过程,下同)
(2)从中取出lmL,将其用水稀释到l00mL,所得溶液中溶质的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
A.加热水至100℃[其中c(H+)=1×10-6mol·L-1]B.向水中加入NaHSO4
C.向水中加入Cu(NO3)2D.在水中加入Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】㈠用系统命法写出下列物质名称:
(1)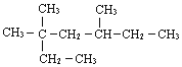 ______
______
(2)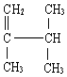 ______
______
(3)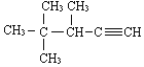 的系统名称为 ______
的系统名称为 ______
(4)键线式![]() 表示的分子式 ______ ,名称是 ______ .
表示的分子式 ______ ,名称是 ______ .
㈡判断同分异构体的种类(不考虑立体异构):
(1)某烷烃的相对分子质量为114且分子中含有两个相同的支链则该烷烃可能的结构共有________种;
(2)“立方烷”( )与氯气发生取代反应生成的二氯代物共有___种;
)与氯气发生取代反应生成的二氯代物共有___种;
(3)甲苯的二氯取代物共有_____种;
(4)“金刚烷”( )它可看作是由四个等同的六元环组成的空间构型.请判断:
)它可看作是由四个等同的六元环组成的空间构型.请判断:
①一溴代物有____种;
②由氯原子取代金刚烷亚甲基(﹣CH2﹣)中氢原子所形的二氯取代物共有___种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,向10mL0.40mol/LH2O2 溶液中加入少量FeCl3溶液(忽略整个过程中溶液体积的变化),不同时刻测得生成O2的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0 | 9.9 | 17.5 | 22.4 |
资料显示,反应分两步进行:①2Fe3++H2O2=2Fe2++2H++O2;②H2O2+2Fe2++2H+=2H2O+2Fe3+。反应过程中能量变化如图所示。下列说法正确的是

A. Fe2+的作用是增大过氧化氢的分解速率
B. 反应①、②均是放热反应
C. 反应2H2O2(aq)=2H2O(l)+O2(g)是吸热反应
D. 0~6min内的平均反应速率v(H2O2)=3.33×10-2mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(原创)如图表示不同温度下水溶液中c(H+)与c(OH-)的关系,下列判断正确的是( )
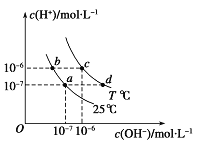
A.两条曲线上任意点均有c (H+) ×c (OH-)=Kw
B.T<25℃
C.b点和c点pH均为6,溶液呈酸性
D.只采用升温的方式,可由a点变成d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
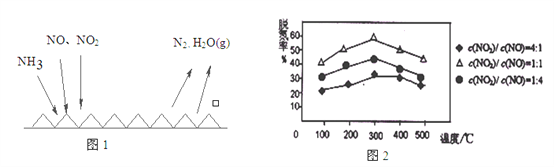
①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL) | 100 | 200 | 300 | 400 |
剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
放出气体的体积(mL) | 2240 | 4480 | 6720 |
计算原混合物中铁和铜的物质的量比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度和压强下,对反应CO2(g)+H2(g)![]() CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 | H2 | CO | H2O |
甲 | amol | amol | 0mol | 0mol |
乙 | 2amol | amol | 0mol | 0mol |
丙 | 0mol | 0mol | amol | amol |
丁 | amol | 0mol | amol | amol |
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲B. 乙>丁>甲>丙
C. 丁>乙>丙=甲D. 丁>丙>乙>甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com