
【题目】下列各种关于酸的使用,其中正确的是
A. 为了抑制Fe2+的水解,用稀硝酸酸化 B. 检验溶液中是否含有SO![]() 时,先用盐酸酸化
时,先用盐酸酸化
C. 乙酸与乙醇的酯化反应中,浓硫酸起到了催化剂和脱水剂的作用 D. 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. 35Cl和37Cl互为同位素B. O2和O3互为同素异形体
C. CH4和C2H6互为同系物D.  和
和 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在试管A中先加入3 mL无水乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸,最后加入2 mL冰醋酸,按下图装置进行实验,并将产生的蒸气经导管通到试管B中饱和碳酸钠溶液的液面上。请回答下列问题:

(1)浓硫酸的作用是__________________________________________。
(2)试管B中观察到的现象是_____________________________。
(3)若试管B中的饱和碳酸钠溶液用冷水代替,实验结束后不能闻到香味的可能原因是________________________________________________________________________。
(4)试管B中的饱和碳酸钠溶液的作用是__________________________________。
(5)通入蒸气的导管不能插入试管B中液面下的原因是_______________________________________。
(6)通入蒸气常选用长导管的目的是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____kJ·mol-1。
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____(填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
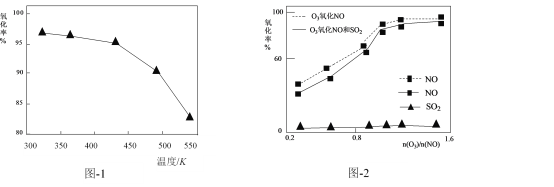
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普拉西坦是一种能改善记忆、抗健忘的中枢神经药。下列关于普拉西坦的说法正确的是 ( )
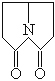
A. 一氯取代物只有5种
B. 二氯取代物只有5种
C. 可发生水解反应
D. 与2-氨基环丁二烯丙酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,破坏的作用力相同的是
A.干冰升华和碘升华B.HCl溶于水和NaCl溶于水
C.石英熔化和冰熔化D.NH4Cl受热分解和HI受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:
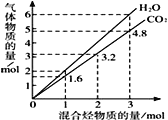
①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A. 2 min时H2O2的浓度c(H2O2)=0.314mol/L
B. 0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C. 6~10 min,过氧化氢的平均反应速率v(H2O2)=2.75×10-2mol/(L·min)
D. 反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、NH3、H2O、HF是第二周期的氢化物,也是生产生活中的重要物质。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4的燃烧热为________________。
(2) NH3和H2O中稳定性较高的是:___________,NH3和PH3中沸点较高的是:__________。
(3)如图所示组成闭合回路,其中,甲装置是由CH4、O2和CO2为反应物,稀土金属材料为电极,以熔融碳酸盐为电解质形成的原电池;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。

①装置中气体A为________(填“CH4”或“O2和CO2”),d极上的电极反应式为_______________________________________。
②乙装置中a极上的电极反应式为___________________。
若在a极产生112 mL(标准状况)气体,则甲装置中消耗CH4________mL(标准状况),乙装置中所得溶液的pH=________(忽略电解前后溶液体积变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com