
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____kJ·mol-1。
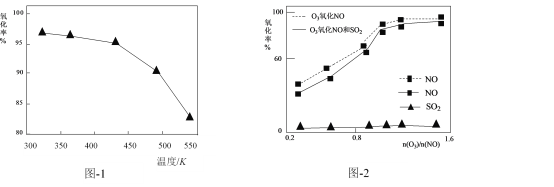
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____(填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____。
【答案】![]() O3在较高温度下易分解 NaNO3 SO2的氧化消耗了少量O3,减小了O3的浓度 a b 2CO(NH2)2+ 6NO
O3在较高温度下易分解 NaNO3 SO2的氧化消耗了少量O3,减小了O3的浓度 a b 2CO(NH2)2+ 6NO![]() 5N2+2CO2+4H2O CO(NH2)2 - 6e- + 8OH- = CO32-+ N2↑+ 6H2O
5N2+2CO2+4H2O CO(NH2)2 - 6e- + 8OH- = CO32-+ N2↑+ 6H2O
【解析】
根据盖斯定律可将热化学方程式进行加减运算。解释实验结果,必须先清楚实验现象(图象数据关系),再用化学原理分析可能原因。
(1)将三个已知热化学方程式自上而下编号为①②③,(1)中所求热化学方程式编号为④。消去无关物质,保留有关物质,得④=③×![]() +②-①×
+②-①×![]() ,得ΔH=ΔH3×
,得ΔH=ΔH3×![]() +ΔH2-ΔH1×
+ΔH2-ΔH1×![]() =
=![]() 。
。
(2)O3氧化NO的反应为NO +O3=NO2 +O2 。温度升高,O3分解为O2,使NO的氧化率下降。 NO2、NO3组成的混合物相当于N2O5(物质的量之比1:1时),N2O5是酸性氧化物,用NaOH溶液吸收时生成盐的化学式为NaNO3。
(3)图-2表明相同条件下,有SO2时NO的氧化率略低于无SO2时NO的氧化率。可能是共存的SO2消耗了少量O3,使与NO反应的O3略有减少。
脱硝反应为NO +O3=NO2 +O2,脱硫反应为SO2 +O3=SO3 +O2。图-2表明相同条件下,脱硝反应中NO氧化率较高,脱硫反应中SO2氧化率很低。可能是脱硝反应活化能小、反应快,脱硫反应活化能大、反应慢。能解释该结果的是a b 。
(4)由反应物的组成元素,可判断生成的三种无毒气体是N2、CO2、H2O,进而写出化学方程式 2CO(NH2)2+ 6NO![]() 5N2+2CO2+4H2O。该反应设计成碱性燃料电池时,负极CO(NH2)2失电子,负极反应为CO(NH2)2 - 6e- + 8OH- = CO32- + N2↑ + 6H2O;正极NO得电子,正极反应为2NO+4e-+ 2H2O=N2↑ + 4OH-。
5N2+2CO2+4H2O。该反应设计成碱性燃料电池时,负极CO(NH2)2失电子,负极反应为CO(NH2)2 - 6e- + 8OH- = CO32- + N2↑ + 6H2O;正极NO得电子,正极反应为2NO+4e-+ 2H2O=N2↑ + 4OH-。


科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。

①该电池的负极是______(填“a”或“b”)电极。
②写出正极的电极反应式:_____________。
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) ![]() N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中![]() 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
B. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P-Cl键
C. 28 g N60单质(见图)中含有的N-N(σ)键个数为3NA
D. 235g核互![]() 发生裂变反应:
发生裂变反应:![]() +
+![]() +
+![]() +10
+10![]() ,净产生的中子(n)数为10NA
,净产生的中子(n)数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯原子核外有________种不同运动状态的电子;基态溴原子的价电子排布式为_______;比较氟、氯、溴单质熔点的高低并说明理由___________。
(2)HF极易溶于水的原因是______。
(3)已知高碘酸有两种形式,化学式分别为H5IO6(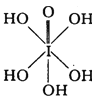 )和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
)和HIO4,前者为 五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6______HIO4。(填“>”、“<”或“=”)
(4)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____,中心原子的杂化类型为_____。
(5)[LiC60]PF6与NaCl具有类似的晶胞结构([LiC60]+表示1个Li+位于1个C60内部)。[LiC60]PF6晶体中包含的化学键有_____________(多选,填字母);
A.金属键B.离子键 C.极性键D.非极性键E.范德华力
已知[LiC60]PF6晶体晶胞边长为a nm,计算[LiC60]PF6晶体的密度为_______g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中不考虑两球的浮力变化)

A. 杠杆为导体或绝缘体时,均为A端高B端低
B. 杠杆为导体或绝缘体时,均为A端低B端高
C. 当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D. 当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多钒酸盐在催化、医学等领域有着重要的应用。某多钒酸铵晶体的化学式为(NH4)xH6-xV10O28·10H2O。为测定其组成, 进行下列实验:
①称取样品0.9291 g,加入过量20% NaOH溶液,加热煮沸一段时间,生成的NH3用50.00 mL 0.1000 mol·L-1 盐酸吸收。加入指示剂,用0.1000 mol·L-1 NaOH标准溶液滴定剩余的HCl,终点时消耗NaOH标准溶液20.00 mL。
②另称取样品0. 9291 g,加过量1.5 mol·L-1 H2SO4,微热溶解。加入3 g NaHSO3,搅拌,使五价钒V10O286-完全转化为四价钒VO2+。加热煮沸一段时间,然后用0. 06000 mol·L-1 KMnO4标准溶液滴定(还原产物为Mn2+),终点时消耗KMnO4标准溶液25.00 mL。
(1)在实验②中,煮沸的目的是____。
(2)KMnO4滴定时,将VO2+氧化为五价的VO2+,该反应的离子方程式为____。
(3)根据实验结果,确定该多钒酸铵晶体的化学式。____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种关于酸的使用,其中正确的是
A. 为了抑制Fe2+的水解,用稀硝酸酸化 B. 检验溶液中是否含有SO![]() 时,先用盐酸酸化
时,先用盐酸酸化
C. 乙酸与乙醇的酯化反应中,浓硫酸起到了催化剂和脱水剂的作用 D. 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂能用于鉴别SO2和CO2气体的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③④⑤B.③④
C.①②③⑤D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常用的酸碱指示剂酚酞的结构简式如图所示,下列关于酚酞的说法不正确的是( )
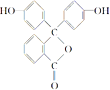
A. 酚酞属于芳香族化合物
B. 酚酞的分子式为C20H14O4
C. 分子中所有碳原子可能共平面
D. 酚酞具有官能团羟基能与钠发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com