
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
B. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P-Cl键
C. 28 g N60单质(见图)中含有的N-N(σ)键个数为3NA
D. 235g核互![]() 发生裂变反应:
发生裂变反应:![]() +
+![]() +
+![]() +10
+10![]() ,净产生的中子(n)数为10NA
,净产生的中子(n)数为10NA
【答案】C
【解析】
A、氢原子个数为0.4NA,而1个甲醇分子中含4个H,故甲醇的分子个数为0.1NA个,而1个甲醇分子中含5条σ键,故0.1NA个甲醇分子中含0.5NA条σ键,选项A错误;B、PCl3与Cl2反应生成PCl5的反应是可逆反应,所以1molPCl3与1molCl2反应制备PCl5,增加的P-Cl键的数目小于2NA个,选项B错误;C.由N60结构图可知,每N原子呈3个N-N键,每个N-N键为N原子提供![]() 个N-N键,所以N60分子中共有N-N数目为:60×3×
个N-N键,所以N60分子中共有N-N数目为:60×3×![]() =90,28g N60单质的物质的量为:
=90,28g N60单质的物质的量为:![]() =
=![]() mol,含有的氮氮键的物质的量为:
mol,含有的氮氮键的物质的量为:![]() mol×90=3mol,含有的N-N键键数为3NA,选项C正确;D、
mol×90=3mol,含有的N-N键键数为3NA,选项C正确;D、![]() +
+![]() +
+![]() +10
+10![]() 净产生的中子为10-1=9个,则235g核素
净产生的中子为10-1=9个,则235g核素![]() 发生裂变反应净产生的中子(
发生裂变反应净产生的中子(![]() )数为9NA,选项D错误;答案选C。
)数为9NA,选项D错误;答案选C。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 12C和14C互为同素异形体
B. 金刚石和C60互为同位素
C. CH3-CH2-CH2-CH3和![]() 互为同分异构体
互为同分异构体
D. C2H2和C6H6互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A. 35Cl和37Cl互为同位素B. O2和O3互为同素异形体
C. CH4和C2H6互为同系物D.  和
和 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,难溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
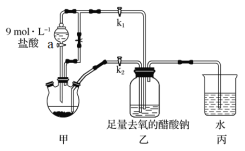
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭k2打开k1,旋开a的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭a的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥、称量。
(1)实验中所用蒸馏水需经煮沸后迅速冷却,目的是________________________。仪器a的名称是__________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为____________。
(3)实验步骤③中溶液自动转移至装置乙中的实验操作为___________________。
(4)装置丙中导管口水封的目的是______________________________________。
(5)为洗涤[Cr(CH3COO)2]2·2H2O产品,下列方法中最合适的是________。
a.先用盐酸洗,后用水洗 b.先用水洗,后用乙醚洗
c.先用水洗,后用乙醇洗 d.先用乙醇洗,后用乙醚洗
(6)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验CO的存在_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:
xA(g)+yB(g)![]() pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
(1)反应2min内,vA=________________,vB=________________;
(2)化学方程式中,x=_____、y=_____、p=______、q=________;
(3)反应平衡时,D为2amol,则B的转化率为________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在试管A中先加入3 mL无水乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸,最后加入2 mL冰醋酸,按下图装置进行实验,并将产生的蒸气经导管通到试管B中饱和碳酸钠溶液的液面上。请回答下列问题:

(1)浓硫酸的作用是__________________________________________。
(2)试管B中观察到的现象是_____________________________。
(3)若试管B中的饱和碳酸钠溶液用冷水代替,实验结束后不能闻到香味的可能原因是________________________________________________________________________。
(4)试管B中的饱和碳酸钠溶液的作用是__________________________________。
(5)通入蒸气的导管不能插入试管B中液面下的原因是_______________________________________。
(6)通入蒸气常选用长导管的目的是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要污染物SO2、NOx)经O3预处理后用碱液吸收,可减少烟气中SO2、NOx的含量。常温下,O3是一种有特殊臭味、稳定性较差的淡蓝色气体。O3氧化烟气中NOx时主要反应的热化学方程式为:
2NO(g) +O2(g)=2NO2(g) H1= a kJ·mol-1
NO(g) +O3(g)=NO2(g) +O2(g) H2= b kJ·mol-1
4NO2(g) +O2(g) =2N2O5(g) H3= c kJ·mol-1
(1)反应6NO2 (g) +O3(g)=3N2O5(g) H=____kJ·mol-1。
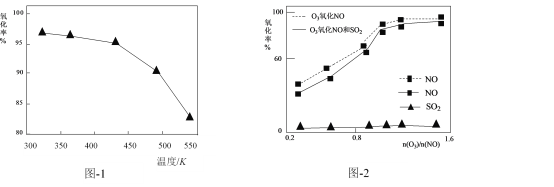
(2)O3氧化NO的氧化率随温度变化情况如图-1。随着温度升高NO的氧化率下降的原因可能是____。NO也可被O3氧化为 NO2、NO3,用NaOH溶液吸收若只生成一种盐,该盐的化学式为____。
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验。实验结果如图-2。同时脱硫脱硝时NO的氧化率略低的原因是____;由图可知SO2对 NO的氧化率影响很小,下列选项中能解释该结果的是____(填序号)。
a.O3氧化SO2反应的活化能较大
b.O3与NO反应速率比O3与SO2反应速率快
c.等物质的量的O3与NO反应放出的热量比与SO2反应的多
(4)尿素[CO(NH2)2]在高温条件下与NO反应转化成三种无毒气体,该反应的化学方程式为____。也可将该反应设计成碱性燃料电池除去烟气中的氮氧化物,该燃料电池负极的电极反应式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表。忽略溶液体积变化,下列叙述不正确的是( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
A. 2 min时H2O2的浓度c(H2O2)=0.314mol/L
B. 0~4 min的平均反应速率v(H2O2)=3.75×10-2mol/(L·min)
C. 6~10 min,过氧化氢的平均反应速率v(H2O2)=2.75×10-2mol/(L·min)
D. 反应到6 min时,H2O2分解了50%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com