
����Ŀ�������Ǹ�ˮ����[Cr(CH3COO)2]2��2H2O��һ���������ռ���Ϊ����ɫ���壬�ױ������������Ҵ���������ˮ������(�ӷ����л��ܼ�)�����Ʊ�װ�ü��������£�
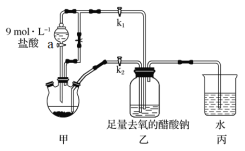
�ټ��װ�������Ժ���������ƿ�����μ������п��������CrCl3��Һ��
�ڹر�k2��k1������a�����������ƺõ��١�
�۴�������ƿ�ڵ���Һ������ɫ(Cr3��)��Ϊ����ɫ(Cr2��)ʱ������Һת�Ƶ�װ�����У������ִ�������ɫ����ʱ���ر�a��������
�ܽ�װ�����л������ٹ��ˡ�ϴ�Ӻ��������
��1��ʵ������������ˮ�辭��к�Ѹ����ȴ��Ŀ����________________________������a��������__________��
��2��������ƿ�е�Zn��������������H2�⣬��������һ����Ӧ�����ӷ���ʽΪ____________��
��3��ʵ�鲽�������Һ�Զ�ת����װ�����е�ʵ�����Ϊ___________________��
��4��װ�ñ��е��ܿ�ˮ���Ŀ����______________________________________��
��5��Ϊϴ��[Cr(CH3COO)2]2��2H2O��Ʒ�����з���������ʵ���________��
a����������ϴ������ˮϴ b������ˮϴ����������ϴ
c������ˮϴ�������Ҵ�ϴ d�������Ҵ�ϴ����������ϴ
��6��һ�������£�[Cr(CH3COO)2]2��2H2O���ȵõ�CO��CO2�Ļ�����壬�����ʵ�����CO�Ĵ���_____________________________________________��
���𰸡���ȥˮ�е��ܽ��� ��Һ©�� Zn��2Cr3��===2Cr2����Zn2�� �ر�k1����k2 ��ֹ��������װ����������Cr2�� b �������ͨ�����ȵ�CuO��������ɫ�ɺ�ɫ��Ϊ��ɫ��˵����������к���CO(���������𰸾���)
��������
װ�üף���Һ©��ʢװϡ���ᣬ��Բ����ƿ��п�����ᷴӦZn+2HCl�TZnCl2+H2����ͬʱ����2CrCl3+Zn�T2CrCl2+ZnCl2��������������������ѹǿ�����ɵ�CrCl2��Һѹ��װ�����У�װ���ң�2Cr2++4CH3COO-+2H2O�T[Cr��CH3COO��2]22H2O��װ�ñ��DZ���װ��ѹǿƽ�⣬ͬʱ����������룻��1������[Cr(CH3COO)2]2��2H2O�ױ�������������ˮ�辭��к�Ѹ����ȴ��Ŀ��������װ��ͼ��������a�����ƣ���2������������ƿ�з����ķ�Ӧ���з�������3��ʵ�鿪ʼ����H2����Ϊʹ���ɵ�CrCl2��Һ��CH3COONa��Һ˳����ϣ���K2�ر�K1�������ɵ�CrCl2��Һѹ��װ��3�У���4������[Cr(CH3COO)2]2��2H2O�ױ���������װ�ñ��е��ܿ�ˮ���Ŀ������5�������Ǹ�ˮ���ﲻ������ˮ���ѣ����ڴ������������ᣬ�ݴ�ѡ��ϴ���Լ�����7��CO�ܻ�ԭ���ȵ�����ͭ���ݴ���Ƽ���CO�ķ�����
��1�� [Cr(CH3COO)2]2��2H2O�ױ���������������ˮ�辭��к�Ѹ����ȴ��Ŀ���dz�ȥˮ�е��ܽ���������װ��ͼ������a�������Ƿ�Һ©������2��������ƿ�е�Zn��������������H2�⣬ͬʱ����2CrCl3+Zn�T2CrCl2+ZnCl2�����ӷ���ʽΪ2Cr3++Zn�T2Cr2++Zn2+����3��ʵ�鿪ʼ����H2����Ϊʹ���ɵ�CrCl2��Һ��CH3COONa��Һ˳����ϣ���K2�ر�K1�������ɵ�CrCl2��Һѹ��װ�����з�Ӧ����4�� [Cr(CH3COO)2]2��2H2O�ױ�������װ�ñ��е��ܿ�ˮ���Ŀ���Ƿ�ֹ��������װ����������Cr2������5�������Ǹ�ˮ���ﲻ������ˮ���ѣ����ڴ������������ᣬ��������ˮϴ����������ϴ��ѡb����7���������ͨ�����ȵ�CuO��������ɫ�ɺ�ɫ��Ϊ��ɫ��˵����������к���CO��


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪C��C���������Ƽ�����ת��ij���ṹ��ʽ�ɱ�ʾΪ![]() ������˵������ȷ����
������˵������ȷ����
A. ������������9��̼ԭ�Ӵ���ͬһƽ����
B. ������һ�ȴ���ֻ��һ��
C. ������������10��̼ԭ�Ӵ���ͬһƽ����
D. �����DZ���ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(N2H4)��һ����ɫ������ˮ����״Һ�壬���м��Ժͼ�ǿ�Ļ�ԭ�ԣ��ڹ�ҵ������Ӧ�÷dz��㷺��

(1)��֪�µ����ģ����ͼ��ʾ��д���µĵ���ʽ:____________��
(2)��֪1g��(N2H4)����ȼ�����ɵ�����ˮ�������ų�16.7kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ:______________��
(3)Ŀǰ�����з���һ-����ȼ�ϵ�صĽṹ����ͼ��ʾ��

�ٸõ�صĸ�����______(�a����b��)�缫��
��д�������ĵ缫��Ӧʽ:_____________��
(4)��1L�̶�����������м���0.1molN2H4����303K��Pt���·�����Ӧ:N2H4(l) ![]() N2(g)+2H2(g)�����������
N2(g)+2H2(g)�����������![]() ��ʱ���ϵ����ͼ��ʾ����0��4min�ڵ�����ƽ����Ӧ����v(N2)=______��
��ʱ���ϵ����ͼ��ʾ����0��4min�ڵ�����ƽ����Ӧ����v(N2)=______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ800 ��ʱA��B��C�����������ܱ������з�ӦʱŨ�ȵı仯��ֻ��ͼ�Ϸ������ܵó��Ľ�����(����)
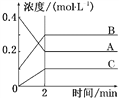
A. A�Ƿ�Ӧ��
B. ǰ2 min A�ķֽ�����Ϊ0.1 mol��L��1��min��1
C. ��ƽ����������¶ȣ�ƽ��������Ӧ�����ƶ�
D. ��Ӧ�ķ���ʽΪ2A(g)![]() 2B(g)��C(g)
2B(g)��C(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������F��һ��ʳƷ���ʼ����ɰ�����;���ϳɣ�

��֪��RCHO��CH3CHO![]() RCH(OH)CH2CHO��
RCH(OH)CH2CHO��
�Իش�
��1��A�Ļ�ѧ������_________��A��B�ķ�Ӧ������_________��
��2��B��C��Ӧ�Ļ�ѧ����ʽΪ_____________________________��
��3��C��D�����Լ��ͷ�Ӧ�����ֱ���_____________��
��4��E�Ľṹ��ʽ��______________��F�й����ŵ�������________________��
��5������˫��̼�ϵ��ǻ����ȶ�����ת��Ϊ�ʻ�����D��ͬ���칹���У�ֻ��һ�����ķ����廯������______�֡����б�����ֻ��һ��ȡ�������˴Ź���������5���壬�������Ϊ2��1��2��2��1��ͬ���칹��Ľṹ��ʽΪ______________��
��6��д�����Ҵ�Ϊԭ���Ʊ�2-��ϩȩ�ĺϳ�·�ߣ������Լ���ѡ����_____________���ϳ�·������ͼʾ�����£�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��û�ѧ����ش��������⣺
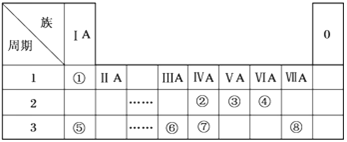
(1)�ڴ�Ԫ�����ڱ���һ�����У���������ǿ��Ԫ����__________(��Ԫ�ط���)��
(2)�ݡ���ԭ�Ӱ뾶�ɴ�С��˳��Ϊ_______(��Ԫ�ط���)��
(3)�ڡ��ۡ��ߵ���ۺ������������ǿ������˳����___________(�ѧʽ)��
(4)�١��ܡ��ݡ����е�ijЩԪ�ؿ��γɼȺ����Ӽ��ֺ����Թ��ۼ��Ļ����д������һ�ֻ�����ĵ���ʽ��___________________________��
(5)�ɱ�������Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬�������ϡ��Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ(�����)_________________��
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(6)�ɱ���Ԫ���γɵij�������X��Y��Z��M��N�ɷ������·�Ӧ��
![]()
X��Һ��Y��Һ��Ӧ�����ӷ���ʽΪ______________��N���ĵ��ʵĻ�ѧ����ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��ԭ����Ϊ0.4NA��CH3OH�����к��еĦҼ���Ϊ0.4NA
B. �ܱ�������1 mol PCl3��1 mol Cl2��Ӧ�Ʊ� PCl5��g��������2NA��P-Cl��
C. 28 g N60���ʣ���ͼ���к��е�N��N���ң�������Ϊ3NA
D. 235g�˻�![]() �����ѱ䷴Ӧ��
�����ѱ䷴Ӧ��![]() +
+![]() +
+![]() +10
+10![]() �������������ӣ�n����Ϊ10NA
�������������ӣ�n����Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ԭ�Ӻ�����________�ֲ�ͬ�˶�״̬�ĵ��ӣ���̬��ԭ�ӵļ۵����Ų�ʽΪ_______���ȽϷ����ȡ��嵥���۵�ĸߵͲ�˵������___________��
��2��HF��������ˮ��ԭ����______��
��3����֪�ߵ�����������ʽ����ѧʽ�ֱ�ΪH5IO6��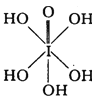 ����HIO4��ǰ��Ϊ ��Ԫ�ᣬ����ΪһԪ�ᡣ��Ƚ϶�������ǿ����H5IO6______HIO4�����������������������
����HIO4��ǰ��Ϊ ��Ԫ�ᣬ����ΪһԪ�ᡣ��Ƚ϶�������ǿ����H5IO6______HIO4�����������������������
��4��X��������ⶨ�ȷ��֣�I3AsF6�д���I3+���ӡ�I3+���ӵļ��ι���Ϊ_____������ԭ�ӵ��ӻ�����Ϊ_____��
��5��[LiC60]PF6��NaCl�������Ƶľ����ṹ��[LiC60]����ʾ1��Li��λ��1��C60�ڲ�����[LiC60]PF6�����а����Ļ�ѧ����_____________����ѡ������ĸ����
A��������B�����Ӽ� C�����Լ�D.�Ǽ��Լ�E�����»���
��֪[LiC60]PF6���徧���߳�Ϊa nm������[LiC60]PF6������ܶ�Ϊ_______g��cm��3���ú�a��NA��ʽ�ӱ�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ������ڼ���SO2��CO2������ǣ� ��
��ʯ��ˮ ��H2S��Һ ��KMnO4��Һ ����ˮ ��Ʒ����Һ
A.�٢ڢۢܢ�B.�ۢ�
C.�٢ڢۢ�D.�ڢۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com