
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
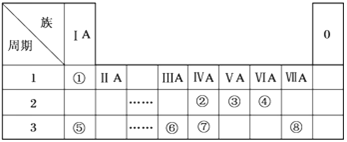
(1)在此元素周期表的一部分中,金属性最强的元素是__________(填元素符号)。
(2)⑤、⑥的原子半径由大到小的顺序为_______(填元素符号)。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________(填化学式)。
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)_________________。
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
![]()
X溶液与Y溶液反应的离子方程式为______________,N→⑥的单质的化学方程式为______________________。
【答案】Na Na>Al HNO3>H2CO3>H2SiO3 Na+[![]() ]-或Na+[
]-或Na+[![]() ]- a、b Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2Al2O3(熔融)
]- a、b Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】
根据元素在周期表的位置可知:元素①-⑧分别为H、C、N、O、Na、Al、Si、Cl。
(1)根据同一周期元素的金属性逐渐减弱,同一主族元素的金属性逐渐增强分析;
(2)同一周期从左到右原子半径逐渐减小;
(3)根据非金属性越强,最高价含氧酸的酸性越强分析判断;
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等;
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,则该化合物为H2O2;
(6)M是仅含非金属的盐,所以一定是铵盐,Z→N→⑥的单质,⑥为Al,所以推断N是氧化铝,Z是氢氧化铝,分析产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应。
根据元素在周期表的位置可知:元素①-⑧分别为H、C、N、O、Na、Al、Si、Cl。
(1)由于在同一周期元素的金属性逐渐减弱,同一主族元素的金属性逐渐增强。所以上述元素中Na的金属性最强;
(2)⑤、⑥分别是钠和铝,根据“同周期元素原子从左到右半径逐渐减小”,则原子半径Na>Al。
(3)②、③、⑦分别为碳、氮和硅,由于同一周期的元素的非金属性逐渐增强,同一主族的元素的非金属性逐渐减弱,元素的非金属性越强,其最高价氧化物对应的水化物酸性越强,元素的非金属性:N>C>Si,所以酸性:HNO3>H2CO3>H2SiO3;
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物可以是NaOH或者NaClO,NaOH电子式为Na+[![]() ]-,NaClO电子式为Na+[
]-,NaClO电子式为Na+[![]() ]-。
]-。
(5)表中两种元素的原子按1∶1组成的常见液态化合物为H2O2,其稀溶液分解常用的催化剂为MnO2和FeCl3,因此答案为a、b;
(6)由图可知:⑥的单质为铝,M为只含非金属元素的盐应该是铵盐,因此X和Y的反应应该是铵盐和氨水之间的反应,Z为Al(OH)3,N为Al2O3,X溶液与Y溶液反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+;电解熔融的氧化铝可以制取金属Al,则N→⑥的单质的化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。


科目:高中化学 来源: 题型:
【题目】下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能大量共存,Al3++3OH-=Al(OH)3↓ |
B | 由水电离出的H+浓度为1×10-12molL-1 | NH4+、Na+、NO3-、Cl- | 一定能大量共存 NH4++H2ONH3H2O+H+ |
C | pH=1的溶液 | Fe2+、Al3+、SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O=2HClO+SO32- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
A.NH3·H2OB.NaOHC.MgCO3D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,回答下列问题:
(1)基态钛原子的价电子排布图为_________________,金属钛晶胞如图1所示,为________________堆积(填堆积方式)。
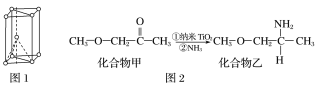
(2)已知TiCl4在通常情况下是无色液体,熔点为-37 ℃,沸点为136 ℃,可知TiCl4为_______晶体。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。化合物乙的沸点明显高于化合物甲,主要原因是_________________________________。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________________。
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图3所示,其化学式为__________。
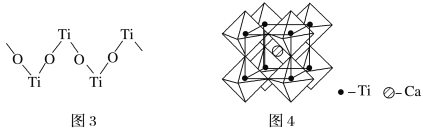
(5)钙钛矿晶体的结构如图4所示。钛离子位于立方晶胞的顶角,被________个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被________个氧离子包围,钙钛矿晶体的化学式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,难溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
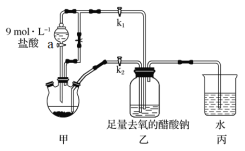
①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭k2打开k1,旋开a的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭a的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥、称量。
(1)实验中所用蒸馏水需经煮沸后迅速冷却,目的是________________________。仪器a的名称是__________。
(2)三颈烧瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为____________。
(3)实验步骤③中溶液自动转移至装置乙中的实验操作为___________________。
(4)装置丙中导管口水封的目的是______________________________________。
(5)为洗涤[Cr(CH3COO)2]2·2H2O产品,下列方法中最合适的是________。
a.先用盐酸洗,后用水洗 b.先用水洗,后用乙醚洗
c.先用水洗,后用乙醇洗 d.先用乙醇洗,后用乙醚洗
(6)一定条件下,[Cr(CH3COO)2]2·2H2O受热得到CO和CO2的混合气体,请设计实验检验CO的存在_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容密闭容器中发生反应2A(g)+B(g)![]() 2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
A. 等于10 s B. 等于12 s
C. 大于12 s D. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:
xA(g)+yB(g)![]() pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
(1)反应2min内,vA=________________,vB=________________;
(2)化学方程式中,x=_____、y=_____、p=______、q=________;
(3)反应平衡时,D为2amol,则B的转化率为________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连成闭合回路,该装置在工作时,下列叙述中正确的是
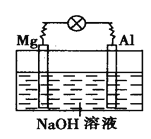
A. 镁比铝活泼,镁失去电子被氧化成Mg2+
B. 铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C. 该装置的内、外电路中,均是电子的定向移动形成
D. 该装置开始工作时,铝片表面的氧化膜可不必处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com